��Ŀ����
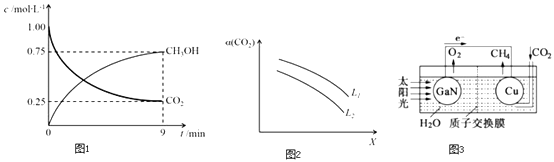
����Ŀ����֪������A��B��C��E��F��G�͵��ʼף�������Ԫ�ؾ�Ϊ������Ԫ�أ�A��Ũ��Һ����ܷ�����ͼ��ʾ�ķ�Ӧ�����dz����ĺ�ɫ���嵥�ʣ���Ϊ���������ṩ���ܣ����dz�������ɫ���嵥�ʣ�B����ɫ�д̼�����ζ�����壬����Ҫ�Ĵ�����Ⱦ��֮һ�������£�C��һ����ɫҺ�壮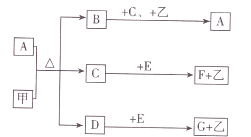
��ش���������
��1��C�Ļ�ѧʽ ��
��2��D�ĵ���ʽ ��
��3��д��C+E��F+�ҵ����ӷ���ʽ ��
��4��д��B+C+�ҡ�A�Ļ�ѧ����ʽ���õ����ű�ʾ����ת�Ƶķ������Ŀ ��
���𰸡�
��1��H2O
��2��![]()
��3��2Na2O2+2H2O=4Na++4OH��+O2��
��4��![]()
���������⣺���dz����ĺ�ɫ���嵥�ʣ���Ϊ���������ṩ���ܣ���֪����C��B����ɫ�д̼�����ζ�����壬����Ҫ�Ĵ�����Ⱦ��֮һ��ΪSO2���壬���AΪŨ������Һ�������£�C��һ����ɫҺ����ˮ��DΪCO2 �� ���������������ˮ��Ӧ�������ᣬ����ΪO2 �� ˮ��������̼����E��Ӧ����������˵��EΪNa2O2 �� ��FΪNaOH��GΪNa2CO3��1��������������֪��CΪH2O�����Դ��ǣ�H2O����2��DΪCO2 �� �����ʽΪ ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ����3��C+E��F+�ҵ����ӷ���ʽΪ2Na2O2+2H2O=4Na++4OH��+O2�������Դ��ǣ�2Na2O2+2H2O=4Na++4OH��+O2������4��B+C+�ҡ�A�Ļ�ѧ����ʽΪ2SO2+O2+2H2O=2H2SO4 �� ת��4e�� �� �����ű�ʾ����ת�Ƶķ������ĿΪ
����3��C+E��F+�ҵ����ӷ���ʽΪ2Na2O2+2H2O=4Na++4OH��+O2�������Դ��ǣ�2Na2O2+2H2O=4Na++4OH��+O2������4��B+C+�ҡ�A�Ļ�ѧ����ʽΪ2SO2+O2+2H2O=2H2SO4 �� ת��4e�� �� �����ű�ʾ����ת�Ƶķ������ĿΪ ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ��
��