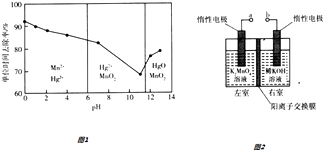
题目内容
【题目】目前,能较稳定存在的氯的氧化物有Cl2O、ClO2、Cl2O7等。有关数据见下表:
化学式 | Cl2O | ClO2 | Cl2O7 |
沸点/℃ | 3.8 | 11.0 | 82.0 |
请回答下列问题:
(1)常温、常压下,三种氧化物中属于气体的是______________。
(2)Cl2O7属于酸性氧化物,它与水反应的离子方程式____________________________。
(3)ClO2是一种常用的消毒剂,我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒。在对水消毒时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,说明ClO2具有_____________性。
(4)工业上可以用下列反应制备ClO2:2NaClO3+H2SO4+SO2=2ClO2+2NaHSO4,请用单线桥法
表示出该反应电子转移的方向和数目______________。
(5)工业上制备ClO2的反应原理为:
NaClO3+ HCl(浓)- ClO2↑+ Cl2↑+ H2O+ NaCl.
①配平方程式:______________。
②浓盐酸在反应中显示出来的性质是__________________(填序号)。
A.还原性 B.氧化性 C.酸性
③若上述反应中产生0.1molClO2,则转移的电子数为___________。
【答案】 Cl2O和ClO2 Cl2O7+H2O=2H++2ClO4- 氧化 ![]() 2,4—2,1,2,2 AC 0.1NA
2,4—2,1,2,2 AC 0.1NA
【解析】(1)常温下,沸点低于25℃的为气体,则结合表格中的数据可知,Cl2O、ClO2为气体,故答案为:Cl2O、ClO2;
(2)Cl2O7属于酸性氧化物,与水反应生成HClO4,离子方程式为:Cl2O7+H2O=2H++2ClO4-,故答案为:Cl2O7+H2O=2H++2ClO4-;
(3)ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,Fe、Mn元素的化合价升高,则Cl元素的化合价降低,可说明ClO2具有氧化性,故答案为:氧化;
(4)反应2NaClO3+H2SO4+SO2=2ClO2+2NaHSO4中Cl元素由+5价降低到+4价,S元素化合价由+4价升高到+6价,转移电子数为2e-,用单线桥法表示该反应电子转移的方向和数目为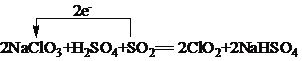 ,故答案为:
,故答案为: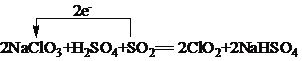 ;
;
(5)①反应NaClO3+ HCl(浓)- ClO2↑+ Cl2↑+ H2O+ NaCl中,NaClO3中氯元素由+5价降低为+4价,HCl中氯元素由-1价升高到0价,根据化合价升降守恒,结合观察法配平为2NaClO3+4HCl(浓)=2ClO2↑+Cl2↑+2H2O+2NaCl,故答案为:2、4、2、1、2、2;
②HCl中的氯元素在产物存在于Cl2,氯元素的化合价升高,氯元素被氧化,HCl作还原剂,同时存在NaCl中氯元素的化合价未变化,故HCl还起酸的作用,故答案为:AC;
③根据反应2NaClO3+4HCl(浓)=2ClO2↑+Cl2↑+2H2O+2NaCl中NaClO3中Cl元素由+5价降低到+4价的ClO2,所以产生0.1molClO2,则转移的电子数为0.1NA,故答案为:0.1NA。

 春雨教育同步作文系列答案
春雨教育同步作文系列答案