题目内容
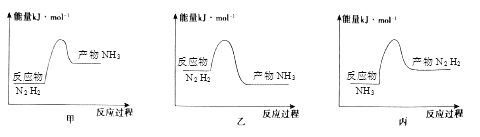
【题目】如图表示两个常见固氮反应的平衡常数对数值(lgK)与温度的关系:
①N2+3H22NH3;②N2+O22NO
根据图中的数据判断下列说法正确的是( )
A.只有反应①是放热反应
B.升温,反应①的速率减小反应②的速率增大
C.可以在常温下利用反应①进行工业固氮
D.曲线的交点表示反应①和反应②体系中 N2 的转化率相等
【答案】A
【解析】A、根据图象①可知温度越高,平衡常数越小,说明升高温度,平衡逆向移动,逆反应方向是吸热反应,则该反应的正反应是放热反应;②温度越高,平衡常数越大,说明升高温度,平衡正向移动,正反应方向是吸热反应,故A符合题意;
B.升高温度,无论是放热反应还是吸热反应,反应速率都增大,故B不符合题意;
C.在常温下,平衡常数虽然很大,但反应速率太慢,不适合工业生产,故C不符合题意;
D.在1000℃时,反应①和反应②体系平衡常数对数值(lgK)相等,而不是N2 的转化率相等,故D不符合题意;
所以答案是:A.
【考点精析】认真审题,首先需要了解化学平衡状态本质及特征(化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)).

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目