题目内容
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
I. 利用反应:6NO2 + 8NH3![]() 7N2 + 12 H2O处理NO2。
7N2 + 12 H2O处理NO2。
II. 一定条件下NO2与SO2可发生反应:NO2(g)+SO2(g)![]() SO3(g)+NO(g) Q (Q>0) 。
SO3(g)+NO(g) Q (Q>0) 。
III. CO可用于合成甲醇,反应方程式为:CO(g) + 2H2(g)![]() CH3OH(g) 。
CH3OH(g) 。
(1)硫离子最外层电子的电子排布式为__________________,氨气分子的电子式为___________,氨气分子属于___________分子(填“极性”或者“非极性”)。
(2)C、O、S、N这四种元素中属于同周期元素的非金属性由强到弱的顺序为_______________,能证明其递变规律的事实是(________)
a、最高价氧化物对应水化物的酸性 b、气态氢化物的沸点
c、单质与氢气反应的难易程度 d、其两两组合形成的化合物中元素的化合价
(3)对于I中的反应,120℃时,该反应在一容积为2L的容器内反应,20min时达到平衡,10min时电子转移了1.2mol,则0~10min时,平均反应速率υ(NO2) =_______________。
(4)对于II中的反应,将NO2与SO2以体积比1:2置于密闭容器中反应,下列能说明反应达到平衡状态的是_____________
a. 体系压强保持不变 b. NO2浓度保持不变
c. NO2和SO3的体积比保持不变 d. 混合气体的平均相对分子质量保持不变
(5)请写出II中反应的平衡常数表达式K=_____________________________________。如果II中反应的平衡常数K值变大,该反应___________
a.一定向正反应方向移动 b. 平衡移动时,正反应速率先减小后增大
c.一定向逆反应方向移动 d. 平衡移动时,逆反应速率先增大后减小
(6)对于III中的反应,CO在不同温度下的平衡转化率与压强的关系如图示。实际生产条件控制在250℃、1.3×104 kPa左右,简述选择此压强的理由:____________________________。

【答案】 3s23p6 ![]() 极性 O>N>C cd 0.015mol/(L·min) b c [SO3][NO]/[NO2] [SO2] a 250℃、1.3×104 kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失
极性 O>N>C cd 0.015mol/(L·min) b c [SO3][NO]/[NO2] [SO2] a 250℃、1.3×104 kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失
【解析】试题分析:(1)硫离子最外层有8个电子,排布式在3s、3p轨道;氨气分子中氮原子通过3个共价键与氢原子结合;氨气分子中为极性共价键,空间构型为三角锥;(2)C、O、S、N这四种元素中,C、O、N为第三周期元素,N属于第四周期元素;同周期元素的非金属性从左到右依次增强;可以根据最高价氧化物的水化物酸性强弱、与氢气化合的难易、气态氢化物的稳定性判断非金属性;(3)6NO2 + 8NH3![]() 7N2 + 12 H2O,电子转移了1.2mol,消耗NO2 0.3mol,根据
7N2 + 12 H2O,电子转移了1.2mol,消耗NO2 0.3mol,根据![]() 计算速率;(4)根据平衡标志分析;(5)II中反应的平衡常数表达式K=
计算速率;(4)根据平衡标志分析;(5)II中反应的平衡常数表达式K=![]() ;NO2(g)+SO2(g)
;NO2(g)+SO2(g)![]() SO3(g)+NO(g) Q (Q>0),正反应吸热,平衡常数增大,说明温度升高;(6)CO(g) + 2H2(g)
SO3(g)+NO(g) Q (Q>0),正反应吸热,平衡常数增大,说明温度升高;(6)CO(g) + 2H2(g)![]() CH3OH(g) 250℃、1.3×104 kPa下,CO的转化率已经很高;
CH3OH(g) 250℃、1.3×104 kPa下,CO的转化率已经很高;
解析:(1)硫离子最外层有8个电子,排布式在3s、3p轨道,硫离子最外层电子的电子排布式为3s23p6;氨气分子中氮原子通过3个共价键与氢原子结合,氨分子的电子式是![]() ;氨气分子中为极性共价键,空间构型为三角锥,所以氨分子是极性分子;(2)C、O、S、N这四种元素中,C、O、N为第三周期元素,N属于第四周期元素;同周期元素的非金属性从左到右依次增强,所以非金属性O>N>C;a、氧元素没有氧化物,故a错误; b、气态氢化物的沸点,不能反映非金属性强弱,故b错误; c、单质越易与氢气反应,非金属性越强,故c正确; d、其两两组合形成化合物时,非金属性强的显负价,故d正确,选cd;(3)6NO2 + 8NH3
;氨气分子中为极性共价键,空间构型为三角锥,所以氨分子是极性分子;(2)C、O、S、N这四种元素中,C、O、N为第三周期元素,N属于第四周期元素;同周期元素的非金属性从左到右依次增强,所以非金属性O>N>C;a、氧元素没有氧化物,故a错误; b、气态氢化物的沸点,不能反映非金属性强弱,故b错误; c、单质越易与氢气反应,非金属性越强,故c正确; d、其两两组合形成化合物时,非金属性强的显负价,故d正确,选cd;(3)6NO2 + 8NH3![]() 7N2 + 12 H2O,电子转移了1.2mol,消耗NO2 0.3mol,
7N2 + 12 H2O,电子转移了1.2mol,消耗NO2 0.3mol, ![]() mol/(L·min);(4)a. 反应前后气体系数和不变,所以压强是恒量,所以压强保持不变,不一定达到平衡状态,故a错误; b.根据化学平衡定义,NO2浓度保持不变一定达到平衡状态,故b正确; c.设开始投料amol NO2与2amolSO2,反应消耗NO2的物质的量为xmol, NO2和SO3的体积比为
mol/(L·min);(4)a. 反应前后气体系数和不变,所以压强是恒量,所以压强保持不变,不一定达到平衡状态,故a错误; b.根据化学平衡定义,NO2浓度保持不变一定达到平衡状态,故b正确; c.设开始投料amol NO2与2amolSO2,反应消耗NO2的物质的量为xmol, NO2和SO3的体积比为![]() ,所以NO2和SO3的体积比是变量,体积比保持不变一定达到平衡,故c正确; d. 根据
,所以NO2和SO3的体积比是变量,体积比保持不变一定达到平衡,故c正确; d. 根据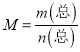 ,混合气体的平均相对分子质量是恒量,平均相对分子质量保持不变不一定达到平衡,故d错误,选bc;(5)II中反应的平衡常数表达式K=
,混合气体的平均相对分子质量是恒量,平均相对分子质量保持不变不一定达到平衡,故d错误,选bc;(5)II中反应的平衡常数表达式K=![]() ;NO2(g)+SO2(g)
;NO2(g)+SO2(g)![]() SO3(g)+NO(g) Q (Q>0),正反应吸热,平衡常数增大,说明温度升高;温度升高时,平衡一定正向移动,故a正确;b. 温度升高时,正反应速率先增大后减小,故b错误; c. 温度升高时,一定向正反应方向移动,故c错误; d. 温度升高,逆反应速率增大,故d错误。(6)CO(g) + 2H2(g)
SO3(g)+NO(g) Q (Q>0),正反应吸热,平衡常数增大,说明温度升高;温度升高时,平衡一定正向移动,故a正确;b. 温度升高时,正反应速率先增大后减小,故b错误; c. 温度升高时,一定向正反应方向移动,故c错误; d. 温度升高,逆反应速率增大,故d错误。(6)CO(g) + 2H2(g)![]() CH3OH(g) 250℃、1.3×104 kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失。
CH3OH(g) 250℃、1.3×104 kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失。






