题目内容
【题目】铬铁矿的成分主要为FeCr2O4,另含有少量Al2O3和SiO2。从铬铁矿中提取铁、铬的化合物,并获得副产物的工艺流程如下:
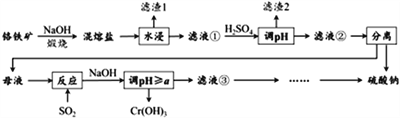
已知“混熔盐”中含有Na2CrO4和NaFeO2等成分,其中NaFeO2极易水解。试回答下列问题:
(1)“滤渣1”为红褐色沉淀,其化学式为_________________;通过水浸生成红褐色沉淀的化学方程式为_________________________________。
(2)向滤液①中加H2SO4“调“pH”的目的:一是使CrO42-转化为Cr2O72-,离子方程式为___________________________________;二是____________________________。
(3)“煅烧”铬铁矿时,主要成分反应的化学方程式为____________________________。
(4)根据下图溶解度(S)~温度(T)曲线判断,对滤液②进行的最佳“分离”方法为_____________(填序号)。
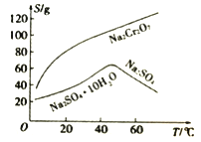
A.蒸发结晶 B.蒸发浓缩,趁热过滤 C.蒸发浓缩,冷却结晶,过滤
(5)“反应”的离子方程式为____________________________。
(6)Cr(OH)3溶于盐酸生成配离子[CrCln(H2O)6-n]x+。0.0015mol[CrCln(H2O)6-n]x+与氢离子交换树脂(HR)完全发生离子交换:[CrCln(H2O)6-n]x++xHR→Rx[CrCln(H2O)6-n] +xH+,生成的H+可与25.00mL 0.1200mol/L NaOH溶液恰好中和。则该配离子的化学式为__________________。
(7)已知25℃时,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=1.0×10-32。则使Cr3+恰好完全沉淀,即溶液中c(Cr3+)=1.0×10-5mol/L时,应调节pH的最小值a为多少___________?(列式计算)
【答案】 Fe(OH)3 NaFeO2+2H2O = NaOH+Fe(OH)3 2 CrO42-+2H+= Cr2O72-+H2O 使AlO2-、SiO32-转化为沉淀,便于过滤分离 4FeCr2O4+20NaOH+7O2![]() 8Na2CrO4+4NaFeO2+10H2O B 3SO2+Cr2O
8Na2CrO4+4NaFeO2+10H2O B 3SO2+Cr2O![]() +2H+===2Cr3++3SO42-+H2O [CrCl(H2O)5]2+ Cr3+完全沉淀时,c(Cr3+)=1. 0×10-5 mol·L-1
+2H+===2Cr3++3SO42-+H2O [CrCl(H2O)5]2+ Cr3+完全沉淀时,c(Cr3+)=1. 0×10-5 mol·L-1
c(OH-)=1.0×10-9 mol·L-1
c(H+)=![]() =1.0×10-5 mol·L-1
=1.0×10-5 mol·L-1
pH=-lg 10-5=5
【解析】考查化学工艺流程,(1)“滤渣1”为红褐色沉淀,其化学式为Fe(OH)3,混熔盐中含有Na2CrO4和NaFeO2,其中NaFeO2极易水解,因此水浸生成红褐色沉淀的化学方程式为NaFeO2+2H2O=Fe(OH)3+NaOH;(2)CrO42-水中存在:2CrO42-+2H+![]() Cr2O72-+H2O,加入硫酸,促进平衡向正反应方向进行,即离子方程式为2CrO42-+2H+=Cr2O72-+H2O,矿石中含有Al2O3和SiO2,与NaOH高温下,生成NaAlO2和Na2SiO3,加入硫酸发生AlO2-+H++H2O=Al(OH)3↓,SiO32-+2H+=H2SiO3,因此目的二使AlO2-、SiO32-转化为沉淀,便于过滤分离;(3)根据产生得到Na2CrO4和NaFeO2,因此方程式为 4FeCr2O4+20NaOH+7O2
Cr2O72-+H2O,加入硫酸,促进平衡向正反应方向进行,即离子方程式为2CrO42-+2H+=Cr2O72-+H2O,矿石中含有Al2O3和SiO2,与NaOH高温下,生成NaAlO2和Na2SiO3,加入硫酸发生AlO2-+H++H2O=Al(OH)3↓,SiO32-+2H+=H2SiO3,因此目的二使AlO2-、SiO32-转化为沉淀,便于过滤分离;(3)根据产生得到Na2CrO4和NaFeO2,因此方程式为 4FeCr2O4+20NaOH+7O2 ![]() 8Na2CrO4+4NaFeO2+10H2O;(4)分离得到Na2SO4,根据图像,操作方法是蒸发浓缩、趁热过滤,故选项B正确;(5)调节pH,得到Cu(OH)3,因此通入SO2的目的是还原Cr2O72-,因此离子方程式为3SO2+Cr2O +2H+=2Cr3++3SO42-+H2O ;(6)根据离子方程式,x=
8Na2CrO4+4NaFeO2+10H2O;(4)分离得到Na2SO4,根据图像,操作方法是蒸发浓缩、趁热过滤,故选项B正确;(5)调节pH,得到Cu(OH)3,因此通入SO2的目的是还原Cr2O72-,因此离子方程式为3SO2+Cr2O +2H+=2Cr3++3SO42-+H2O ;(6)根据离子方程式,x=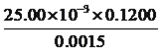 =2,该配离子中Cr显+3价,即n=1,配离子是[CrCl(H2O)5]2+;(7)Cr3+完全沉淀时,c(Cr3+)=1. 0×10-5 mol·L-1,根据溶度积求出c(OH-)=1.0×10-9 mol·L-1 ,c(H+)=
=2,该配离子中Cr显+3价,即n=1,配离子是[CrCl(H2O)5]2+;(7)Cr3+完全沉淀时,c(Cr3+)=1. 0×10-5 mol·L-1,根据溶度积求出c(OH-)=1.0×10-9 mol·L-1 ,c(H+)=![]() =1.0×10-5 mol·L-1 ,pH=-lg 10-5=5。
=1.0×10-5 mol·L-1 ,pH=-lg 10-5=5。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案【题目】在2L密闭容器内,800℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.006 | 0.006 | 0.006 |
(1)上述反应在第5s时NO的转化率是___________。用O2表示从0~2s内该反应的平均速率V(O2)=__________。
(2)下图中表示NO2的变化的曲线是__________。

(3)能使该反应的反应速率增大的是__________。
A.及时分离出NO2气体 B.适当升高温度 C.增大O2的浓度 D.选择高效催化剂
(4)能说明该反应已达到平衡状态的是___________。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=2v正(O2) D.容器内质量保持不变