题目内容
【题目】硒及其化合物在生产、生活中有着广泛的应用,掺杂硒的纳米氧化亚铜常用作光敏材料、电解锰行业催化剂等。
(1)酸性溶液中Na2SO3将H2SeO3和H2SeO4还原为晒单质的反应如下:
H2SeO3(aq)+2SO2(g)+H2O(l)=Se(s)+2H2SO4(aq) △H1
2H2SeO4(aq)+Se(s)+H2O(l)=3H2SO4(aq) △H2
H2SeO4(aq)+2SO2(g)+2H2O(l)=Se(s)+3H2SO4(aq) △H3
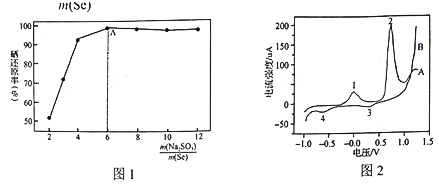
实验中控制其他条件不变(盐酸浓度等),![]() 与硒还原率关系如图1。在A点之前,随着
与硒还原率关系如图1。在A点之前,随着![]() 的增加,Se的还原率不断升高的原因是_____________。
的增加,Se的还原率不断升高的原因是_____________。
(2)向Na2SeO3溶液中加入适量的AgNO3溶液,得到Ag2Se纳米晶体,同时产生N2。该反应的离子方程式为 ______。
(3)制 PbSe 纳米管时还产生了副产物PbSeO3。己知:Ksp(PbSeO3)=3×l0-12, Ksp(PbSe)= 3×l0-38。为了除去PbSe中混有的PbSeO3,可以采取的措施是______。
(4)实验室测得碱性条件下PbSe纳米管在电极表面的氧化还原行为,结果如图2所示。其中一条曲线上的峰表示氧化过程,另一条曲线上的峰表示还原过程。整个过程共发生如下变化:Pb(OH)2—PbO2;Pb(OH)2—Pb; PbSe—Se; PbO2→Pb(OH)2,各物质均难溶于水。峰1对应的电极反应式为:PbSe-2e-+2OH-=Pb(OH)2+Se;则峰2对应的电极反应式为 ______。
(5)掺杂硒的纳米Cu2O催化剂可用于工业上合成甲醇:CO(g)+2H2(g)![]() CH3OH(g) △H=akJ/mol。按n(H2):n(CO)=1:1的投料比将H2与CO充入VL的恒容密闭容器中,在一定条件下发生反应,测得CO的平衡转化率与温度、压强的关系如下图所示。
CH3OH(g) △H=akJ/mol。按n(H2):n(CO)=1:1的投料比将H2与CO充入VL的恒容密闭容器中,在一定条件下发生反应,测得CO的平衡转化率与温度、压强的关系如下图所示。
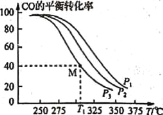
①压强P1、P2、P3由小到大的顺序是 __________。
②T1 ℃时若向该容器中充入2.0 mol H2和2.0 mol CO发生上述反应,5 min后反应达到平衡(M点),则M点对应条件下反应的平衡常数为 ______。
(6)将CuCl水解再热分解可得到纳米Cu2O。CuCl 水解的反应为 CuCl(s) +H2O(1) ![]() CuOH(s)+Cl-(aq)+H+(aq),该反应的平衡常数 K与此温度下Kw、Ksp(CuOH)、Ksp(CuCl)的关系为K=________。
CuOH(s)+Cl-(aq)+H+(aq),该反应的平衡常数 K与此温度下Kw、Ksp(CuOH)、Ksp(CuCl)的关系为K=________。
【答案】溶液中SO2的浓度增大(或产生的SO2对溶液有搅拌作用),加快了化学反应速率,从而使得Se的还原率不断升高 4Ag++2SeO32-+3N2H4H2O═2Ag2Se↓+3N2↑+9H2O 将PbSe纳米管浸泡在Na2Se溶液中,然后用蒸馏水洗涤多次并干燥 Pb(OH)2-2e-+2OH-=PbO2+2H2O P3<P2<P1 ![]()
![]()
【解析】
(1) 在A点之前,由于是酸性溶液,加入的Na2SO3和酸反应生成SO2将H2SeO3和H2SeO4还原,故随着![]() 的增加,即溶液中SO2的浓度增大,能增大反应速率,并对反应溶液起到搅拌作用,从而使得Se的还原率不断升高;
的增加,即溶液中SO2的浓度增大,能增大反应速率,并对反应溶液起到搅拌作用,从而使得Se的还原率不断升高;
(2)向Na2SeO3溶液中加入适量的AgNO3溶液,再加入水合肼(N2H4H2O),120℃反应,得到Ag2Se纳米晶体,同时产生N2,反应是发生在SeO32-和N2H4H2O之间的氧化还原反应,SeO32-被还原为Ag2Se固体,N2H4H2O被氧化为N2,Ag+反应前后化合价不变,根据得失电子数守恒、质量守恒和电荷守恒可知离子方程式为4Ag++2SeO32-+3N2H4H2O═2Ag2Se↓+3N2↑+9H2O;
(3)根据Ksp可知,PbSe的溶解度小于PbSeO3,故可以通过PbSeO3和Na2Se的反应将PbSeO3转化为PbSe,从而达到除去PbSeO3的目的,方法为将PbSe纳米管浸泡在Na2Se溶液中,然后用蒸馏水洗涤多次并干燥;
(4)由于其中一条曲线上的峰表示氧化过程,另一条曲线上的峰表示还原过程,而峰1对应的电极反应式PbSe-2e-+2OH-=Pb(OH)2+Se为氧化反应,故曲线A上的反应均为氧化反应,即峰2所对应反应为Pb(OH)2→PbO2或PbSe→Se,而由于峰1的电极反应为PbSe-2e-+2OH-=Pb(OH)2+Se,生成了Pb(OH)2,故峰2的反应为Pb(OH)2→PbO2,由于环境为碱性的,故电极反应为Pb(OH)2-2e-+2OH-=PbO2+2H2O;
(5)①由图可知,温度一定时,CO的转化率α(P3)<α(P2)<α(P1),该正反应的正反应是气体体积减小的反应,增大压强化学平衡向正反应进行,CO的转化率升高,故压强P1>P2>P3,则压强P1、P2、P3由小到大的顺序是P3<P2<P1;
②T1℃,若向该容器中充入2.0 mol H2和2.0 molCO发生上述反应,5 min后反应达到平衡(M点),CO转化率40%,消耗CO物质的量2mol×40%=0.8mol,结合化学三行计算列式计算, CO(g)+2H2(g)![]() CH3OH(g) △H=a kJ/mol
CH3OH(g) △H=a kJ/mol
起始量(mol) 2 2 0
变化量(mol) 0.8 1.6 0.8
平衡量(mol) 1.2 0.4 0.8
K=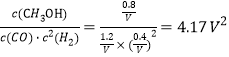 ;
;
(6)CuCl水解的反应为CuCl(s)+H2O(l)![]() CuOH(s)+Cl-(aq)+H+(aq),该反应的平衡常数K=c(H+)c(Cl-)=
CuOH(s)+Cl-(aq)+H+(aq),该反应的平衡常数K=c(H+)c(Cl-)=![]() =
=![]() 。
。

【题目】研究碳、氮及其化合物的转化对于环境的改善有重大意义。
(1)氧化还原法消除NOx的转化如下:NO![]() NO2
NO2![]() N2
N2
已知:NO(g)+O3(g)=NO2(g)+O2(g) ΔH=-200.9 kJ·mol-1
2NO(g)+O2(g)=2NO2(g) ΔH=-116.2 kJ·mol-1
则反应Ⅰ的热化学方程式为_____________________________________________。
(2)有人设想将CO按下列反应除去:2CO(g)=2C(s)+O2(g) ΔH>0,请你分析该设想能否实现并说明理由是____________________________________________。
(3)甲酸的电离平衡常数Ka=1.70×10-4。向20 mL 0.1 mol·L-1的甲酸钠溶液中滴加10 mL 0.1 mol·L-1的盐酸,混合液呈________(填“酸”或“碱”)性,溶液中离子浓度从大到小的顺序为______________________。
(4)活性炭也可用于处理汽车尾气中的NO。在2 L恒容密闭容器中加入0.100 0 mol NO和2.030mol固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量如表所示:
温度 | 固体活性炭/mol | NO/mol | A/mol | B/mol |
200 ℃ | 2.000 | 0.040 0 | 0.030 0 | 0.030 0 |
335 ℃ | 2.005 | 0.050 0 | 0.025 0 | 0.025 0 |
①该反应的正反应为________(填“吸热”或“放热”)反应。
②200 ℃时,平衡后向恒容容器中再充入0.1 mol NO,再次平衡后,NO的百分含量将________(填“增大”“减小”或“不变”)。
③计算反应在335 ℃时的平衡常数为________。
(5)工业生产尾气中的CO2捕获技术之一是氨水溶液吸收技术,工艺流程是将烟气冷却至15.5~26.5℃后用氨水吸收过量的CO2,该反应的化学方程式为_______________________。在用氨水吸收前,烟气需冷却至15.5~26.5℃的可能原因是____________________________。