题目内容
10.Cl2是纺织工业中常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”.S2O32-和Cl2反应的产物之一为SO42-.下列说法中,不正确的是( )| A. | 该反应中氧化剂是Cl2 | |
| B. | 根据该反应可判断还原性:S2O32->Cl- | |
| C. | 上述反应中,每生成l mol SO42-,转移4 mol电子 | |
| D. | SO2与氯气的漂白原理相同,所以也可以用SO2做纺织工业的漂白剂 |
分析 S2O32-和Cl2反应的产物之一为SO42-,S元素的化合价升高,则Cl元素的化合价降低,结合氧化还原反应中的概念及规律来解答.
解答 解:S2O32-和Cl2反应的产物之一为SO42-,S元素的化合价升高,则Cl元素的化合价降低,
A.因Cl元素的化合价降低,所以氧化剂是Cl2,故A正确;
B.由还原剂的还原性大于还原产物的还原性可知,还原性:S2O32->Cl-,故B正确;
C.每生成l mol SO42-,由化合价变化则转移(6-2)×l mol=4mol电子,故C正确;
D.SO2与氯气的漂白原理不相同,氯气是利用其氧化性,而二氧化硫是利用化合反应,故D错误;
故选D.
点评 本题考查氧化还原反应,明确习题中的信息是解答的关键,抓住S2O32-和Cl2反应的产物之一为SO42-即可解答,注意电子守恒的应用,题目难度中等.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
5.下列离子方程式书写正确的是( )
| A. | 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O═2HClO+CO32- | |
| B. | 向Fe(NO3)2和NaBr混合溶液中滴加稀盐酸:6Br-+8H++2NO3-═3Br2+2NO↑+4H2O | |
| C. | Na2S溶液中滴加NClO溶液:S2-+ClO-+H2O═S↓+Cl-+2OH- | |
| D. | 双氧水使酸性KMnO4溶液褪色:2MnO4-+5H2O2═2Mn2++5O2↑+6OH-+2H2O |
15.已知Na2SO3在空气中易被氧化为Na2SO4,现有一包包装破损的白色Na2SO3固体粉末,为了检验其是否变质,正确的方法是( )
| A. | 取少量样品于试管中,滴入稀盐酸,无沉淀,再滴入BaCl2溶液,若有白色沉淀产生,则说明已变质 | |
| B. | 取少量样品于试管中,滴入稀硝酸,再滴入BaCl2溶液,若有白色沉淀产生,则说明已变质 | |
| C. | 取少量样品于试管中,滴入稀硫酸,再滴入BaCl2溶液,若有白色沉淀产生,则说明已变质 | |
| D. | 取少量样品于试管中,滴入稀盐酸,若产生使品红溶液褪色的气体,则说明已变质 |
2.关于金属的腐蚀和防护的叙述中,正确的是( )
| A. | 金属被腐蚀的本质是M+nH2O═M(OH)n+$\frac{n}{2}$H2↑ | |
| B. | 对某些工具的“机械转动部位”选用刷油漆的方法来防锈 | |
| C. | 金属在一般情况下发生的电化学腐蚀主要是吸氧腐蚀 | |
| D. | 常温下,置于空气中的金属主要发生化学腐蚀 |
19.下列说法正确的是( )
| A. | 原电池是把电能转化为化学能的装置 | |
| B. | 原电池中电子流出的一极是正极,发生氧化反应 | |
| C. | 原电池的两极发生的反应均为氧化还原反应 | |
| D. | 形成原电池后,电子有负极向正极移动 |
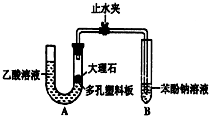 某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.
某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验. H,C,N,Cr是中学化学常见的几种元素.它们的单质及化和物在生产,生活,科研等方面应用广泛.请回答下列问题:
H,C,N,Cr是中学化学常见的几种元素.它们的单质及化和物在生产,生活,科研等方面应用广泛.请回答下列问题: