题目内容
1. 某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.
某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.Ⅰ.探究乙酸、碳酸和苯酚的酸性强弱关系
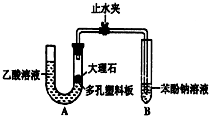
该校学生设计了如下实验装置(夹持仪器已略去).
(1)实验前如何检查装置A的气密性?先关闭止水夹,从左管向U型管内加水,至左管液面高于右管液面,静置一段时间后,若U型管两侧液面差不发生变化,则气密性良好;大理石与乙酸溶液反应的化学方程式为CaCO3+2CH3COOH=Ca(CH3COO)2+CO2↑+H2O.
(2)装置A中反应产生的气体通入苯酚钠溶液中,反应的离子方程式为C6H5O-+CO2+H2O→C6H5OH+HCO3-.
(3)有学生认为(2)中的实验现象不足以证明碳酸的酸性比苯酚强,理由是乙酸有挥发性,挥发出的乙酸也可以和苯酚钠溶液反应,生成苯酚,改进该装置的方法
是在装置A和B之间连一个盛有饱和氢钠溶液的洗气瓶.
Ⅱ.证明乙酸为弱酸.
(4)现有pH=3的乙酸溶液、蒸馏水、石蕊试液及pH试纸,用最简便的实验方法证明乙酸为弱酸:用量筒量取一定体积的乙酸溶液,加蒸馏水稀释100倍,用pH试纸测其pH,pH<5,则证明乙酸是弱酸(或其他合理答案).
分析 (1)根据体系内产生的压强是否变化来判断装置的气密性,碳酸钙和醋酸反应生成醋酸钙和水、二氧化碳;
(2)二氧化碳和苯酚钠反应生成不易溶于水的苯酚和碳酸氢钠,根据离子方程式的书写规则书写;
(3)要防止醋酸干扰实验,在气态未和苯酚反应前将其除去,可选用饱和的碳酸氢钠溶液除去醋酸且又不引进新的杂质气体;
(4)证明乙酸为弱酸需证明溶液中存在电离平衡,依据提供的试剂可以对溶液稀释测定溶液PH的变化分析判断是否存在电离平衡分析设计.
解答 解:(1)检查装置A的气密性时,先关闭止水夹,从左管向U型管内加水,至左管液面高于右管液面,静置一段时间后,若U型管两侧液面差不发生变化,则气密性良好;碳酸钙和醋酸反应生成醋酸钙和水、二氧化碳,反应方程式为CaCO3+2CH3COOH=Ca(CH3COO)2+CO2↑+H2O,
故答案为:先关闭止水夹,从左管向U型管内加水,至左管液面高于右管液面,静置一段时间后,若U型管两侧液面差不发生变化,则气密性良好;CaCO3+2CH3COOH=Ca(CH3COO)2+CO2↑+H2O;
(2)二氧化碳和苯酚钠反应生成不易溶于水的苯酚和碳酸氢钠,所以看到的现象是溶液出现浑浊,反应离子方程式为:C6H5O-+CO2+H2O→C6H5OH+HCO3-,
故答案为:C6H5O-+CO2+H2O→C6H5OH+HCO3-;
(3)乙酸有挥发性,挥发出的乙酸也可以和苯酚钠溶液反应,生成苯酚,要防止醋酸干扰实验,在气态未和苯酚反应前将其除去,可选用饱和的碳酸氢钠溶液除去醋酸且又不引进新的杂质气体,所以在装置A和B之间连一个盛有饱和碳酸氢钠溶液的洗气瓶除去醋酸,
故答案为:乙酸有挥发性,挥发出的乙酸也可以和苯酚钠溶液反应,生成苯酚;在装置A和B之间连一个盛有饱和氢钠溶液的洗气瓶;
(4)明乙酸为弱酸需证明溶液中存在电离平衡,依据提供的试剂可以对溶液稀释测定溶液PH的变化,实验步骤为:取pH=3的乙酸溶液加入蒸馏水稀释100倍,用pH试纸测定溶液的pH小于5,
故答案为:用量筒量取一定体积的乙酸溶液,加蒸馏水稀释100倍,用pH试纸测其pH,pH<5,则证明乙酸是弱酸(或其他合理答案).
点评 本题考查了比较弱酸酸性强弱的方法、证明弱电解质的方法,题目难度中等,注意掌握比较弱电解质酸性强弱常用的方法.

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案| A. | SO2溶解于水 | B. | CO2溶解于水 | C. | NO2溶解于水 | D. | NH3溶解于水 |
| 有机物 | 加入试剂 | 预期现象 |
| (1)甲苯 | 酸性高锰酸钾 | |
| (2)苯乙烯 | 溴水 | |
| (3)苯酚 | 呈紫色 | |
| (4)葡萄糖 | 出现红色沉淀 | |
| (5)淀粉 | 碘水 | |
| (6)鸡蛋清 | 浓硝酸 |
| A. | 三种意见都支持上述反应为氧化还原反应,且电子转移数相同 | |
| B. | 通过闻生成气体气味可判断反应快慢 | |
| C. | 用稀硫酸可鉴别硫代硫酸钠、亚硫酸钠溶液 | |
| D. | 生成的气体可漂白酸性高锰酸钾溶液 |
| A. | 离子半径:X+>Y- | |
| B. | Z元素的最高正化合价与最低负化合价代数和为4 | |
| C. | X、Y、Z可以形成XYZ、XYZ3、XYZ4等化合物 | |
| D. | Y的氢化物中存在离子键 |
| A. | 该反应中氧化剂是Cl2 | |
| B. | 根据该反应可判断还原性:S2O32->Cl- | |
| C. | 上述反应中,每生成l mol SO42-,转移4 mol电子 | |
| D. | SO2与氯气的漂白原理相同,所以也可以用SO2做纺织工业的漂白剂 |
| A. | 一定含有Na2O、Na2O2和NaHCO3 | B. | 一定含有Na2O和NaCl | ||
| C. | 不会有Na2CO3和NaCl | D. | 不会有NaHCO3和Na2CO3 |
 反应时断裂的化学键是( )
反应时断裂的化学键是( )