题目内容
20.西班牙的瑞奥汀河是一条酸河,河水中含有硫酸和硫酸亚铁.经调查发现,酸河形成的原因是由于上游河床含有的某种物质R在水中氧的作用下发生反应所致,其反应的化学方程式为:2R+2H2O+7O2═2FeSO4+2H2SO4,则R的化学式为( )| A. | FeS | B. | Fe2S3 | C. | FeS2 | D. | FeO |
分析 由题意知反应的化学方程式为2R+2H2O+7O2=2FeSO4+2H2SO4,根据质量守恒定律:①宏观意义:反应物和生成物的总质量不变,元素种类、质量不变;②微观意义:原子种类不变,原子数目不变,原子质量不变,故可推测R的化学式.
解答 解:根据质量守恒定律:①宏观意义:反应物和生成物的总质量不变,元素种类、质量不变;②微观意义:原子种类不变,原子数目不变,原子质量不变.可知“2R”中含有4个硫原子、2个亚铁离子,故其化学式为FeS2.
故选C.
点评 掌握有关化学式的计算和推断方法;掌握质量守恒定律的有关原子种类及个数不变的知识是解题的关键所在.

练习册系列答案
 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
10.Cl2是纺织工业中常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”.S2O32-和Cl2反应的产物之一为SO42-.下列说法中,不正确的是( )
| A. | 该反应中氧化剂是Cl2 | |
| B. | 根据该反应可判断还原性:S2O32->Cl- | |
| C. | 上述反应中,每生成l mol SO42-,转移4 mol电子 | |
| D. | SO2与氯气的漂白原理相同,所以也可以用SO2做纺织工业的漂白剂 |
11.某种干燥粉末混合物由Na2O2、Na2O、Na2CO3、NaHCO3和NaCl中两种或两种以上组成(假设固体混合时不反应),若将其与足量盐酸反应,则逸出气体a,当气体a 缓缓地通过足量NaOH溶液时气体体积缩小(同温同压),但仍有剩余.另取混合物放在空气中加热至无气体发生为止,冷却后剩余固体的质量增加了.则原混合物的判断正确的是( )
| A. | 一定含有Na2O、Na2O2和NaHCO3 | B. | 一定含有Na2O和NaCl | ||
| C. | 不会有Na2CO3和NaCl | D. | 不会有NaHCO3和Na2CO3 |
8.2009“中国水周”的主题是:“落实科学发展观,节约保护水资源”.下列认识和做法不符合这一主题的是( )
| A. | 洗菜、洗衣、淘米的水用来浇花、拖地、冲厕所 | |
| B. | 加强工业废水的排放监控,坚持达标排放 | |
| C. | 合理施用农药、化肥,以减少水体污染 | |
| D. | 淡水资源丰富,所以淡水可以取之不尽、用之不竭 |
15.在2A+B═2C反应中,已知A的相对分子质量为24,C的相对分子质量为40,则B的相对分子质量为( )
| A. | 16 g | B. | 32 g | C. | 16 | D. | 32 |
9.加热蒸发NaCl溶液的过程中,下列物理量保持不变的是( )
| A. | NaCl溶液的体积 | B. | NaCl的质量分数 | ||
| C. | NaCl的物质的量 | D. | NaCl的物质的量浓度 |
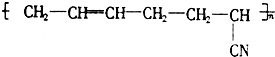 丁腈橡胶具有优良的耐油、耐高温性能,合成丁腈橡胶的原料是( )
丁腈橡胶具有优良的耐油、耐高温性能,合成丁腈橡胶的原料是( )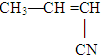 ⑤CH3-CH═CH2 ⑥CH3-CH=CH-CH3.
⑤CH3-CH═CH2 ⑥CH3-CH=CH-CH3.