ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩœΓΆΝ‘ΣΥΊΑϋά®ν÷ΓΔνΤΚΆογœΒΘ®Κ§CeΓΔEu )Ι≤17÷÷‘ΣΥΊΘ§ «÷Ί“ΣΒΡ’Ϋ¬‘Ή ‘¥Θ§Έ“ ΓœΓΆΝΉ ‘¥Ζ«≥ΘΖαΗΜΘ°Ρ≥≤ …ΪΒγ ”Μζœ‘ ΨΤΝ…ζ≤ζΙΐ≥Χ÷–≤ζ…ζ¥σΝΩΒΡΖœ”ΪΙβΖέΡ©Κ§ ( Eu2O3ΓΔSiO2ΓΔFe2O3ΓΔCeO2ΓΔMnO Β»Έο÷ Θ©Θ°Ρ≥ΩΈΧβΉι“‘¥ΥΖέΡ©ΈΣ‘≠ΝœΘ§ …ηΦΤ»γœ¬ΙΛ“’Νς≥ΧΕ‘Ή ‘¥Ϋχ––ΜΊ ’Θ§ΒΟΒΫΫœΈΣ¥ΩΨΜΒΡCeO2ΚΆEu2O3 Θ®―θΜ·νπΘ©Θ°
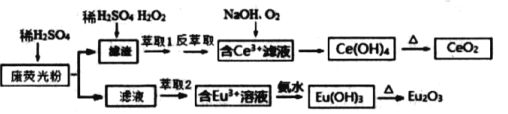
“―÷ΣΘΚCeO2 ≤Μ»ή”Ύ½NΝρΥαΘ§“≤≤Μ»ή”ΎNaOH »ή“ΚΘ§Eu2O3Ω…»ή”ΎœΓΝρΥα
(1)Άυ¬Υ‘ϋ÷–Φ”œΓΝρΥαΚΆH2O2Ϋχ––ΥαΫΰΘ§Ζ¥”ΠΒΡάκΉ”ΖΫ≥Χ Ϋ____________ ΓΘΈΣΝΥΧαΗΏΥαΫΰ¬ Θ§Ω…“‘ Β±ΧαΗΏΖ¥”ΠΈ¬Ε»Θ§ΒΪΈ¬Ε»ΤΪΗΏΫΰ≥ω¬ Ζ¥ΕχΜαΦθ–ΓΘ§Τδ‘≠“ρ «________________________________ΓΘ
(2)”–ΜζΈοHRΡήΫΪCe3+¥”Υ°»ή“Κ÷–ίΆ»Γ≥ωά¥Θ°ΗΟΙΐ≥ΧΩ…±μ ΨΈΣΘΚCe3+Θ®Υ°≤ψΘ©+3HR(”–Μζ≤ψ)![]() CeR3(”–Μζ≤ψΘ©+3H+(Υ°≤ψΘ©ΓΘœρ CeR3(”–Μζ≤ψΘ©÷–Φ”»κœΓΝρΥαΫχ––Ζ¥ίΆ»ΓΡήΜώΒΟΫœ¥ΩΒΡΚ§Ce3+Υ°»ή“ΚΘ§¥”ΤΫΚβΫ«Ε»Ϋβ ΆΤδ‘≠“ρΘΚ________________________ΓΘ
CeR3(”–Μζ≤ψΘ©+3H+(Υ°≤ψΘ©ΓΘœρ CeR3(”–Μζ≤ψΘ©÷–Φ”»κœΓΝρΥαΫχ––Ζ¥ίΆ»ΓΡήΜώΒΟΫœ¥ΩΒΡΚ§Ce3+Υ°»ή“ΚΘ§¥”ΤΫΚβΫ«Ε»Ϋβ ΆΤδ‘≠“ρΘΚ________________________ΓΘ
(3)Νς≥Χ÷–”…Κ§ Ce3+¬Υ“Κ…ζ≥…Ce(OH)4ΒΡάκΉ”ΖΫ≥Χ Ϋ____________________ΓΘ
(4)»Γ…œ ωΝς≥Χ÷–ΒΟΒΫΒΡCe(OH)4 ≤ζΤΖ 0.52 g, Φ”ΝρΥα»ήΫβΚσΘ§”Ο≈®Ε»ΈΣ 0.1000molL-1FeSO4±ξΉΦ»ή“ΚΒΈΕ®÷Ν÷’Βψ ±Θ§νφ±ΜΜΙ‘≠ΈΣCe3+ , œϊΚΡ 24.00 mL ±ξΉΦ»ή“ΚΓΘΗΟ≤ζΤΖ÷– Ce(OH)4ΒΡ÷ ΝΩΖ÷ ΐΈΣ___________ΓΘ
(5)“―÷ΣΚ§ Ce3+»ή“Κ“≤Ω…“‘œ»Φ”ΦνΒς pHΚσ‘ΌΆ®»κ―θΤχ―θΜ·Ω…ΒΟΒΫCe(OH)4ΓΘ298K ±,Ksp[Ce(OH)3]=5ΓΝ10-20Θ§»τ»ή“Κ÷–c(Ce3+)=0.05molL-1, Φ”ΦνΒςΫΎpH ΒΫ_____ ±Ce3+ΩΣ Φ≥ΝΒμΘ®Κω¬‘Φ”ΦνΙΐ≥Χ÷–»ή“ΚΧεΜΐ±δΜ·Θ©Θ°
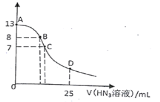
(6)ίΆ»ΓΦΝΕ‘Ϋπ τάκΉ”ΒΡίΆ»Γ¬ ”κ pHΒΡΙΊœΒ»γΆΦΥυ ΨΘ°Νς≥Χ÷–ΈΣΝΥ”ΟίΆ»ΓΦΝ≥ΐ»ΞΫπ τ‘”÷ άκΉ”Θ§Ϋχ––ίΆ»Γ2 Ήν “ΥΒΡpH «_______Θ®Χν―Γœν–ρΚ≈Θ©Θ°Τδ‘≠“ρ « _____ΓΘ
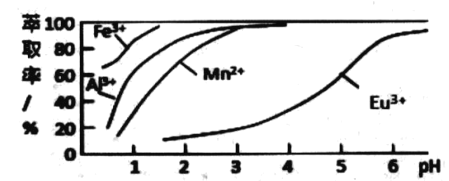
A. 2.0 Ήσ”“ B . 3.0 Ήσ”“ C. 5.0 Ήσ”“
ΓΨ¥πΑΗΓΩ2CeO2+H2O2+6H+=2Ce3++O2Γϋ+4H2O Έ¬Ε»…ΐΗΏΘ§H2O2 ή»»“ΉΖ÷ΫβΘ§‘λ≥…Ϋΰ≥ω¬ ΤΪΒΆΘΜ Φ”»κœΓΝρΥα ±Θ§cΘ®H+Θ©‘ω¥σΘ§ΤΫΚβœρ–Έ≥…Ce3+ΒΡΖΫœρ“ΤΕ·Θ§ 4Ce3++O2+12OH-+2H2O=4Ce(OH)4 96% 8 B ΙFe3+ΓΔMn2+Άξ»Ϊ≥ΐ»ΞΘ§≤ΔΖά÷ΙEu3+±ΜίΆ»ΓΒΦ÷¬Υπ ß
ΓΨΫβΈωΓΩ
Ζœ”ΪΙβΖέΡ©Κ§ ( Eu2O3ΓΔSiO2ΓΔFe2O3ΓΔCeO2ΓΔMnO Β»Έο÷ Θ©Θ§Φ”»κΝρΥαΘ§¬Υ“ΚΚ§”–Eu3+ΓΔFe3+ΓΔMn2+Β»Θ§Ψ≠ίΆ»ΓΘ§Ω…≥ΐ»ΞFe3+ΓΔMn2+Β»Θ§Φ”»κΑ±Υ°Θ§Ω……ζ≥…EuΘ®OHΘ©3Θ§Φ”»»Ζ÷ΫβΩ……ζ≥…Eu2O3ΘΜ¬Υ‘ϋ÷–Κ§”–CeO2 ΓΔSiO2Θ§Φ”»κœΓΝρΥαΚΆΙΐ―θΜ·«βΘ§Ψ≠ίΆ»ΓΓΔΖ¥ίΆ»ΓΘ§Ω…ΒΟΒΫΚ§”–Ce3+ΒΡ»ή“ΚΘ§Φ”»κ«β―θΜ·ΡΤ≤ΔΆ®»κ―θΤχΘ§Ω……ζ≥…CeΘ®OHΘ©4Θ§Φ”»»Ω……ζ≥…CeO2ΓΘ
Θ®1Θ©‘ΎΥαΫΰ ±ΖΔ…ζΒΡάκΉ”Ζ¥”ΠΈΣ2CeO2+H2O2+6H+=2Ce3++O2Γϋ+4H2OΘ§H2O2 ή»»“ΉΖ÷ΫβΘ§ΈΣΖά÷ΙΤδΖ÷ΫβΘ§‘ρΈ¬Ε»≤Μ“ΥΧΪΗΏΘ§Ι ¥πΑΗΈΣΘΚ2CeO2+H2O2+6H+=2Ce3++O2Γϋ+4H2OΘΜΈ¬Ε»…ΐΗΏΘ§H2O2 ή»»“ΉΖ÷ΫβΘ§‘λ≥…Ϋΰ≥ω¬ ΤΪΒΆΘΜ
Θ®2Θ©ΗυΨίΤΫΚβCe3+Θ®Υ°≤ψΘ©+3HR(”–Μζ≤ψ)![]() CeR3(”–Μζ≤ψΘ©+3H+(Υ°≤ψΘ©Θ§œρ CeR3(”–Μζ≤ψΘ©÷–Φ”»κœΓΝρΥα ±Θ§cΘ®H+Θ©‘ω¥σΘ§ΤΫΚβœρ–Έ≥…Ce3+ΒΡΖΫœρ“ΤΕ·Θ§‘ρCe3+¥”Υ°»ή“Κ÷–±ΜίΆ»Γ≥ωά¥Θ§Ι ¥πΑΗΈΣΘΚΦ”»κœΓΝρΥα ±Θ§cΘ®H+Θ©‘ω¥σΘ§ΤΫΚβœρ–Έ≥…Ce3+ΒΡΖΫœρ“ΤΕ·ΘΜ
CeR3(”–Μζ≤ψΘ©+3H+(Υ°≤ψΘ©Θ§œρ CeR3(”–Μζ≤ψΘ©÷–Φ”»κœΓΝρΥα ±Θ§cΘ®H+Θ©‘ω¥σΘ§ΤΫΚβœρ–Έ≥…Ce3+ΒΡΖΫœρ“ΤΕ·Θ§‘ρCe3+¥”Υ°»ή“Κ÷–±ΜίΆ»Γ≥ωά¥Θ§Ι ¥πΑΗΈΣΘΚΦ”»κœΓΝρΥα ±Θ§cΘ®H+Θ©‘ω¥σΘ§ΤΫΚβœρ–Έ≥…Ce3+ΒΡΖΫœρ“ΤΕ·ΘΜ
Θ®3Θ©Νς≥Χ÷–Ce3+”κ―θΤχΓΔ«β―θΜ·ΡΤΖ¥”Π…ζ≥… Ce(OH)4Θ§άκΉ”ΖΫ≥Χ ΫΈΣ4Ce3++O2+12OH-+2H2O=4Ce(OH)4Θ§Ι ¥πΑΗΈΣΘΚ4Ce3++O2+12OH-+2H2O=4Ce(OH)4ΘΜ
Θ®4Θ©Ce(OH)4Φ”ΝρΥα»ήΫβΚσΘ§±ΜFeSO4ΜΙ‘≠ΈΣCe3+ ,‘ρ”–Ce(OH)4~ Ce3+~ FeSO4Θ§‘ρn[Ce(OH)4]=0.1ΓΝ24ΓΝ10-3mol=2.4ΓΝ10-3molΘ§m[Ce(OH)4]=2.4ΓΝ10-3molΓΝ208g/mol=0.4992gΘ§ΗΟ≤ζΤΖΒΡ¥ΩΕ»ΈΣΘΚ![]() Θ§Ι ¥πΑΗΈΣΘΚ96%ΘΜ
Θ§Ι ¥πΑΗΈΣΘΚ96%ΘΜ
Θ®5Θ©298K ±Θ§Ksp[Ce(OH)3]=5ΓΝ10-20Θ§»τ»ή“Κ÷–c(Ce3+)=0.05molL-1, Ce3+ΩΣ Φ≥ΝΒμΘ§‘ρcΘ®OH-Θ©=![]() Θ§‘ρpH=8Θ§Ι ¥πΑΗΈΣΘΚ8ΘΜ
Θ§‘ρpH=8Θ§Ι ¥πΑΗΈΣΘΚ8ΘΜ
Θ®6Θ©»ή“Κ÷–¥φ‘ΎEu3+ΓΔMn2+Ϋπ τάκΉ”Θ§”…ίΆ»ΓΦΝΕ‘Ϋπ τάκΉ”ΒΡίΆ»Γ¬ ”κ pHΒΡΙΊœΒΆΦΩ…÷ΣΘ§ΒςΫΎpH‘Ύ3.0Ήσ”“Θ§Ω… ΙFe3+ΓΔMn2+Άξ»Ϊ≥ΐ»ΞΘ§≤ΔΖά÷ΙEu3+±ΜίΆ»ΓΒΦ÷¬Υπ ßΘ§Ι ¥πΑΗΈΣΘΚBΘΜ ΙFe3+ΓΔMn2+Άξ»Ϊ≥ΐ»ΞΘ§≤ΔΖά÷ΙEu3+±ΜίΆ»ΓΒΦ÷¬Υπ ßΓΘ

 ‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗ
‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗ