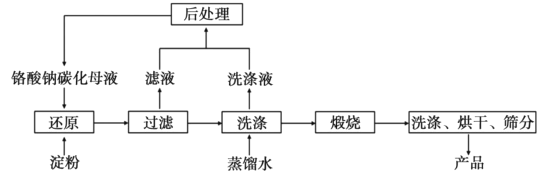
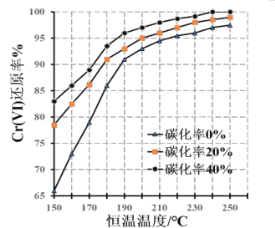
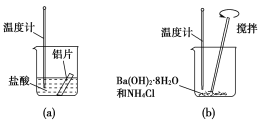
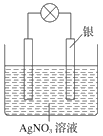
题目内容
【题目】下列解释事实的方程式,不正确的是
A.铁粉与硫粉混合加热反应:Fe + S![]() FeS
FeS
B.红热的铜丝与硫蒸气化合:Cu + S ![]() CuS
CuS
C.镁条在氮气中燃烧:3Mg+N2 ![]() Mg3N2
Mg3N2
D.红热的木炭与浓硫酸反应:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
【答案】B
【解析】
A.S将Fe氧化为+2价,生成FeS,反应的化学方程式为:Fe + S![]() FeS,A正确;
FeS,A正确;
B.S将Cu氧化为+1价,生成Cu2S,反应的化学方程式为:2Cu + S![]() Cu2S,B错误;
Cu2S,B错误;
C.镁条在氮气中燃烧生成氮化镁,反应的化学方程式为:3Mg+N2![]() Mg3N2,C正确;
Mg3N2,C正确;
D.浓硫酸有强氧化性,能将C氧化成CO2,反应的化学方程式为:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O,D正确。
CO2↑+2SO2↑+2H2O,D正确。
答案选B。

练习册系列答案
相关题目