题目内容
10. MnO2是碱锰电池材料中最普通的正极材料之一,在活性材料MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能.
MnO2是碱锰电池材料中最普通的正极材料之一,在活性材料MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能.(1)写出基态Mn原子的核外电子排布式1s22s22p63s23p63d54s2.
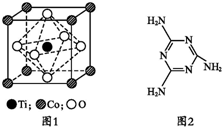
(2)CoTiO3晶体结构模型如图1所示.在CoTiO3晶体中1个Ti原子、1个Co原子,周围距离最近的O原子数分别为6个、12个.
(3)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理.O2在其催化作用下,可将CN-氧化成CNO-,进而得到N2.与CNO-互为等电子体的分子、离子化学式分别为CO2(或N2O、CS2、BeCl2等)、N3-(各写一种).
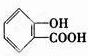
(4)三聚氰胺是一种含氮化合物,其结构简式如图2所示.三聚氰胺分子中氮原子轨道杂化类型是sp2、sp3,1mol三聚氰胺分子中σ键的数目为15NA.
(5)硝酸比亚硝酸酸性强的原因硝酸中N呈+5价,N-O-H中O的电子更向N偏移,导致其越易电离出氢离子,硝酸完全电离,亚硝酸部分电离.
分析 (1)根据构造原理写出其核外电子排布式;
(2)根据图片判断,1个Ti原子周围距离最近的O原子数目为6,1个Co原子周围距离最近的O原子数目=3×$\frac{1}{2}$;
(3)等电子体中原子个数相等价电子数相等;
(4)根据价层电子对互斥理论确定其杂化方式,根据三聚氰胺和 σ 键的关系式计算;
(5)硝酸与亚硝酸相比,存在一个N对O的配位键,因为这个配位键,使得N显更强的正电性,对羟基中H-O键的电子云的拉力更大,即极性更大,H更容易以质子的形式离去.
解答 解:(1)Mn是25号元素,其原子核外有25个电子,所以其核外电子排布式为:1s22s22p63s23p63d54s2,
故答案为:1s22s22p63s23p63d54s2;
(2)根据图片知,1个Ti原子周围距离最近的O原子数目为6,1个Co原子周围距离最近的O原子数目=3×$\frac{1}{2}$=12,
故答案为:6;12;
(3)CNO-中含有3个原子,16个价电子,所以其得电子体为:CO2(或N2O、CS2、BeCl2等) 和N3-,
故答案为:CO2(或N2O、CS2、BeCl2等);N3-;
(4)三聚氰胺分子中,氨基上的N原子含有3个 σ 键和一个孤电子对,所以采取sp3杂化,环上的N原子含有2个 σ 键和一个孤电子对,所以采取sp2杂化,一个三聚氰胺分子中含有15个σ 键,所以1mol三聚氰胺分子中 σ 键的数目为15NA,
故答案为:sp2、sp3;15NA;
(5)亚硝酸中N+3价,硝酸中N呈+5价,N-O-H中O的电子更向N偏移,导致其越易电离出氢离子,则酸性较大,硝酸完全电离,亚硝酸部分电离,
故答案为:硝酸中N呈+5价,N-O-H中O的电子更向N偏移,导致其越易电离出氢离子,硝酸完全电离,亚硝酸部分电离.
点评 本题涉及核外电子排布式的书写、等电子体、配位数的判断、杂化方式的确定、酸的电离比较等知识点,核外电子排布式的书写是学习难点也是考查热点,注意练习巩固,题目难度中等.

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案| A. | 苯 四氯化碳 | B. | 乙炔 乙烯 | C. | 乙烷 乙烯 | D. | 苯 酒精 |
| A. | 铬、锰 | B. | 铬、硅 | C. | 铬、镍 | D. | 铬、碳 |
②N2(g)+3H2(g)?2NH3(g)△H2=-92.4kJ•mol-1
③2H2(g)+O2(g)═2H2O(g)△H3=-483.6kJ•mol-1
下列说法正确的是( )
| A. | 据反应①可知N2的燃烧热为180 kJ•mol-1 | |
| B. | 2H2O(l)═2H2(g)+O2(g)△H>+483.6 kJ•mol-1 | |
| C. | 反应②在恒温恒容密闭容器反应达平衡后,充入N2,平衡正向移动,氮气的转化率减小,该反应的平衡常数增加 | |
| D. | 可推知,氨的催化氧化的热化学方程式为4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H=-906 kJ•mol-1 |
| A. | 甲醛和乙醛 | B. | 丙烯醛和苯甲醛 | C. | 乙酸和甲酸甲酯 | D. | 甲醛和葡萄糖 |
 .
.
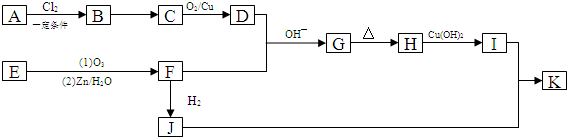
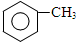 ,B→C的反应类型为:取代反应
,B→C的反应类型为:取代反应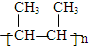
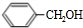 +O2$→_{△}^{Cu}$ 2
+O2$→_{△}^{Cu}$ 2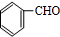 +H2O;I+J→K:
+H2O;I+J→K: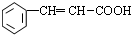 +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$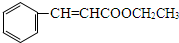 +H2O
+H2O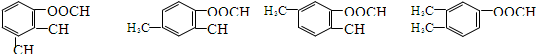 .
.
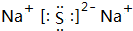 ,属于离子化合物.
,属于离子化合物. .
.