题目内容
5.实验室欲用1.0mol/L的浓NaOH溶液配制250mL 0.1mol/L的稀NaOH溶液:(1)配制稀NaOH溶液时,一般可以分为以下几个步骤:
①量取 ②计算 ③稀释 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容
其正确的操作顺序为②①③⑤⑥⑦④;本实验必须用到的仪器有量筒、玻璃棒、烧杯、250mL容量瓶、胶头滴管.
(2)要完成本实验,该同学应用量筒量取25.0mL的浓NaOH溶液.
(3)配制稀NaOH溶液时,若出现下列操作,导致浓度偏低的是BD.(填写字母,双选)
A.容量瓶洗净后残留少量蒸馏水 B.往容量瓶转移溶液时,有少量液体溅出
C.定容时俯视刻度线 D.定容摇匀后,液面下降又加水至刻度线
E.未冷却至室温就将溶液转移到容量瓶中.
分析 (1)根据配制步骤是计算、量取、稀释、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器判断正确的操作顺序;
(2)根据溶液稀释定律C浓V浓=C稀V稀来计算;
(3)根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析.
解答 解:(1)配制0.10mol/L的NaOH溶液250mL应选择250ml容量瓶,操作步骤有计算、量取、稀释、移液、洗涤、定容、摇匀等操作,所以正确的顺序为:②①③⑤⑥⑦④;
操作步骤有计算、量取、稀释、洗涤、定容、摇匀等操作,一般用量筒量取浓硫酸,在烧杯中稀释(可用量筒量取水加入烧杯),并用玻璃棒搅拌.冷却后转移到250mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以需要的仪器有量筒、烧杯、玻璃棒、250mL容量瓶、胶头滴管,故除了量筒、玻璃棒、烧杯,还需要的仪器有250mL容量瓶、胶头滴管,
故答案为:②①③⑧⑤⑥⑦④;250mL容量瓶、胶头滴管;
(2)设需要的1.0mol/L的浓NaOH溶液体积为VmL,根据溶液稀释定律C浓V浓=C稀V稀可知:
1.0mol/L×VmL=250mL×0.1mol/L
解得V=25.0mL,
故答案为:25.0;
(3)A.若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,故A错误;
B.往容量瓶转移溶液时,有少量液体溅出,会导致溶质的损失,则浓度偏低,故B正确;
C.定容时俯视刻度线,则溶液体积偏小,浓度偏高,故C错误;
D.定容摇匀后,液面下降是正常的,又加水至刻度线导致浓度偏低,故D正确;
E.未冷却至室温就将溶液转移到容量瓶中,待溶液冷却后溶液体积偏小,则浓度偏高,故E错误.
故选BD.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

| A. | ③>④>①=② | B. | ②>①>④>③ | C. | ③>④>②>① | D. | ④>③>①>② |
| A. | 用丁达尔效应可以鉴别溶液和胶体 | |
| B. | 用分液漏斗分离碘与CCl4的混合液 | |
| C. | 某溶液中滴加AgNO3溶液有白色沉淀,说明原溶液中有Cl- | |
| D. | 某溶液中滴加NaOH溶液有蓝色沉淀,说明原溶液中有Cu2+ |
| A. | 一定条件下,铁与水蒸气反应生成8.96L H2时(已折合成标况),转移的电子数为0.8NA | |
| B. | 标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA | |
| C. | 室温下,23gNO2和N2O4的混合气体中含有的N原子数目为0.75NA | |
| D. | 标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA |
| A. | 草酸能使酸性高锰酸钾溶液褪色 | |
| B. | MnO2、FeCl3和CuSO4都可加快H2O2的分解速率 | |
| C. | 要判断反应进行的方向,必须综合考虑体系的焓变和熵变 | |
| D. | 用稀硫酸和Zn反应制H2时,加少量CuSO4溶液对反应速率无影响 |
| A. | 过滤、蒸馏、萃取 | B. | 过滤、结晶、升华 | C. | 分液、溶解、萃取 | D. | 溶解、过滤、结晶 |
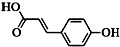 )主要用于制备香辛樱桃、杏、蜂蜜等香料.
)主要用于制备香辛樱桃、杏、蜂蜜等香料.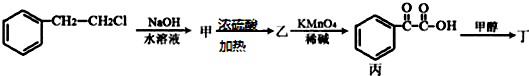
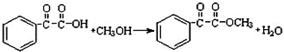
 (任写一个即可).
(任写一个即可).