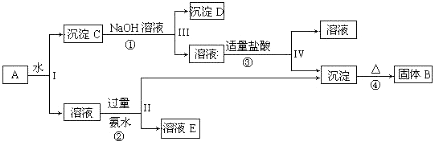
题目内容
12.下列变化属于化学变化的是( )| A. | 碘的升华 | B. | 碘化银用于人工降雨 | ||
| C. | 液溴的气化 | D. | 漂白粉久置失效 |
分析 A.碘的升华是状态变化;
B.利用碘化银能进行人工降雨,碘化银在高空分解生成银单质和碘单质,形成人工冰核;
C.液溴的气化是状态变化;
D.漂白粉长期露置空气中时次氯酸钙与水、二氧化碳反应生成碳酸钙和HClO,HClO易分解,从而变质.
解答 解:A.碘的升华没有新物质生成,属于物理变化,故A错误;
B.利用碘化银能进行人工降雨,降雨时用高炮将碘化银炮弹发射到高空云团的零高度层以上,碘化银在高空分解2AgI=2Ag+I2,生成银单质和碘单质,形成人工冰核,是化学变化,故B正确;
C.液溴的气化是状态变化,属于物理变化,故C错误;
D.漂白粉长期露置空气中时次氯酸钙与水、二氧化碳反应生成碳酸钙和HClO,HClO易分解,从而变质,是化学变化,故D正确.
故选BD.
点评 本题考查物理变化与化学变化的区别与联系,难度不大,解答时要分析变化过程中是否有新物质生成.

练习册系列答案
 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
2.下已知1g氢气完全燃烧生成水蒸气时,放出热量121kJ.且氢气中1mol H-H键断裂时吸收热量为436kJ,水蒸气中1mol H-O键形成时放出热量463kJ,则氧气中1mol O=O键完全断裂时吸收热量为( )
| A. | 932kJ | B. | 496kJ | C. | 738 kJ | D. | 248 kJ |
3.下列说法不正确的是( )
①质子数相同的微粒一定属于同一种元素;
②同位素的性质几乎相同;
③一种元素只能有一种质量数;
④Cl2中35Cl与37Cl的原子个数之比与HCl中的35Cl与37Cl的原子个数之比相等.
①质子数相同的微粒一定属于同一种元素;
②同位素的性质几乎相同;
③一种元素只能有一种质量数;
④Cl2中35Cl与37Cl的原子个数之比与HCl中的35Cl与37Cl的原子个数之比相等.
| A. | ① | B. | ①② | C. | ①②③ | D. | ①②③④ |
20.用NA表示阿伏加德罗常数的值,下列说法错误的是( )
| A. | 32克O2所含的原子数目为2NA | |
| B. | 常温常压下,6.2g Na2O含有的Na+离子数为0.2 NA | |
| C. | 标准状况下,22.4LCO2含有NA个分子 | |
| D. | 物质的量浓度为0.5mol•L-1的MgCl2溶液中,含有Cl-个数为NA |
7.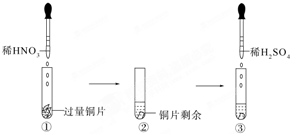 某实验过程如图所示:下列有关图③中出现的现象及解释合理的是( )
某实验过程如图所示:下列有关图③中出现的现象及解释合理的是( )
 某实验过程如图所示:下列有关图③中出现的现象及解释合理的是( )
某实验过程如图所示:下列有关图③中出现的现象及解释合理的是( )| A. | 铜片溶解,因铜与稀H2SO4反应生成SO2 | |
| B. | 铜片溶解,产生无色气体,该气体为H2 | |
| C. | 无明显现象,因稀H2SO4不与铜反应 | |
| D. | 铜片溶解,产生无色气体,该气体在试管口变为红棕色 |
17.常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是( )
| A. | 某物质的溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,则该溶液的pH一定为14-a | |
| B. | 某溶液中存在的离子有S2-、HS-、OH-、Na+、H+,则离子浓度一定是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) | |
| C. | pH=3的二元弱酸H2R溶液与 pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:c(R2-)+c(HR-)=c(Na+) | |
| D. | 将0.2 mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:c(OH-)+c(A-)=c(H+)+c(Na+) |
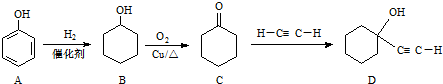
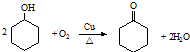 .
.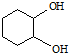 ,反应类型依次是c(选填序号).
,反应类型依次是c(选填序号).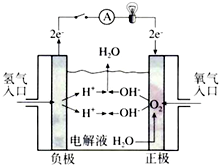 氢氧燃料电池已用于航天飞机.以30%KOH溶液为电解质溶液的这种电池在使用时的电极反应.试写出:
氢氧燃料电池已用于航天飞机.以30%KOH溶液为电解质溶液的这种电池在使用时的电极反应.试写出: