题目内容
10.两种元素X、Y,其原子核外电子层数分别为a、b,最外层电子数分别为m、n.下列说法不正确的是( )| A. | 若8>m>3,则X必定为主族元素 | |
| B. | 若a<b<m=n=4,则晶体类型相同时,其单质熔点:X>Y | |
| C. | 若Y的气态氢化物化学式为YHn,且b<4,则该氢化物为非极性分子 | |
| D. | 若a=b=3,8>m>n>b,则元素非金属性:X>Y |
分析 A.若8>m>3,则X处于ⅢA~ⅦA族;
B.若a<b<m=n=4,二者处于ⅣA族,X为C元素、Y为Si,都形成原子晶体,共价键越短,熔沸点越高;
C.若Y的气态氢化物化学式为YHn,且b<4,可以处于VA族,为NH3等;
D.若a=b=3,8>m>n>b,两种元素位于相同周期,且X原子序数较大,同周期元素从左到右,元素的非金属性逐渐增强.
解答 解:A.若8>m>3,则X一定处于ⅢA~ⅦA族,故A正确;
B.若a<b<m=n=4,二者处于ⅣA族,X为C元素、Y为Si,都形成原子晶体,金刚石中C-C键的键长<晶体Si中Si-Si,故C-C键更稳定,熔沸点:晶体硅<金刚石,故B正确;
C.若Y的气态氢化物化学式为YHn,且b<4,可以处于VA族,为NH3等,NH3为三角锥形,分子中正负电荷中心不重合,属于极性分子,故C错误;
D.若a=b=3,8>m>n>b,两种元素位于第三周期,且X原子序数较大,同周期元素从左到右,元素的非金属性逐渐增强,故则元素非金属性:X>Y,故D正确,
故选C.
点评 本题考查原子结构与元素性质、分子性质、晶体类型与性质等,难度不大,确定元素在周期表中位置是关键,注意元素的不确定性.

练习册系列答案
相关题目
1.下列反应中,硫酸不作氧化剂的是( )
| A. | 2HBr+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Br2+SO2↑+2H2O | |
| B. | Ca3(PO4)2+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2CaSO4+Ca(H2PO4)2 | |
| C. | 2Al+3H2SO4═Al2(SO4)3+3H2↑ | |
| D. | 2KMnO4+5H2S+3H2SO4═K2SO4+2MnSO4+5S↓+8H2O |
5.下列关于物质性质变化的比较,不正确的是( )
| A. | 非金属性:P<S<O<F | B. | 原子半径大小:Na>S>O | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 还原性强弱:F->Cl->I- |
15.下列实验能达到预期目的是( )
| A. | 向淀粉溶液中加入稀硫酸加热后,再用NaOH中和,并做新制氢氧化铜反应实验--检验淀粉是否水解 | |
| B. | 向1-溴丙烷中加入氢氧化钠溶液并加热,再滴加硝酸银和稀硝酸溶液--检验有机物中是否含有溴元素 | |
| C. | 向米汤中加入含碘的食盐,观察是否有颜色的变化--检验含碘食盐中是否含碘酸钾 | |
| D. | 向含苯酚的苯溶液中滴加浓溴水,过滤--除去苯中的苯酚 |
2.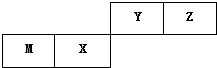 四种短周期元素在周期表中的位置如图,其中只有M元素原子最外层电子数与电子层数相等,下列说法正确的是( )
四种短周期元素在周期表中的位置如图,其中只有M元素原子最外层电子数与电子层数相等,下列说法正确的是( )
 四种短周期元素在周期表中的位置如图,其中只有M元素原子最外层电子数与电子层数相等,下列说法正确的是( )
四种短周期元素在周期表中的位置如图,其中只有M元素原子最外层电子数与电子层数相等,下列说法正确的是( )| A. | 原子半径Z<M | |
| B. | Y的最高价氧化物对应水化物的酸性比X的弱 | |
| C. | 非金属性:X>Z | |
| D. | M元素最高价氧化物对应水化物具有两性 |
19.下列说法正确的是( )
| A. | 直径介于1 nm~100 nm之间的微粒称为胶体 | |
| B. | 制备Fe(OH)3胶体的方法是将饱和FeCl3溶液加热煮沸 | |
| C. | 利用丁达尔效应可以区分溶液和胶体 | |
| D. | 渗析是鉴别溶液和胶体的最简便的方法 |
12.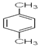 2015年4月在漳州市发生了PX爆炸事件,PX的成分“对二甲苯”,其结构式如图所示:,下列关于PX的叙述中,不正确的是( )
2015年4月在漳州市发生了PX爆炸事件,PX的成分“对二甲苯”,其结构式如图所示:,下列关于PX的叙述中,不正确的是( )
 2015年4月在漳州市发生了PX爆炸事件,PX的成分“对二甲苯”,其结构式如图所示:,下列关于PX的叙述中,不正确的是( )
2015年4月在漳州市发生了PX爆炸事件,PX的成分“对二甲苯”,其结构式如图所示:,下列关于PX的叙述中,不正确的是( )| A. | PX是一种有机化合物 | |
| B. | 仅由碳、氢两种元素组成 | |
| C. | 爆炸燃烧的产物是可能是CO2和H2O | |
| D. | 该有机化合物分子中存在碳碳单键,也存在碳碳双键 |