题目内容
1.下列反应中,硫酸不作氧化剂的是( )| A. | 2HBr+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Br2+SO2↑+2H2O | |
| B. | Ca3(PO4)2+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2CaSO4+Ca(H2PO4)2 | |
| C. | 2Al+3H2SO4═Al2(SO4)3+3H2↑ | |
| D. | 2KMnO4+5H2S+3H2SO4═K2SO4+2MnSO4+5S↓+8H2O |
分析 硫酸在反应中做氧化剂,则所含元素化合价会降低,据此分析解答.
解答 解:A.2HBr+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Br2+SO2↑+2H2O,反应中硫酸中的硫元素化合价降低,硫酸做氧化剂,故A不选;
B.Ca3(PO4)2+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2CaSO4+Ca(H2PO4)2,反应中硫酸中的元素化合价不变,硫酸不做氧化剂,故B选;
C.2Al+3H2SO4═Al2(SO4)3+3H2↑,反应中硫酸中的氢元素化合价降低,硫酸做氧化剂,故C不选;
D.2KMnO4+5H2S+3H2SO4═K2SO4+2MnSO4+5S↓+8H2O,反应中,硫酸中的元素化合价都不变,硫酸不做氧化剂,故D选;
故选:BD.
点评 本题考查了硫酸性质,明确氧化剂的概念及硫酸在反应中所含元素化合价变化是解题关键,题目难度不大.

练习册系列答案
相关题目
11.科学合理的综合利用海水资源,是开发和利用自然资源的重要方面.下列不需要化学变化就能够从水中获得的物质是( )
| A. | 氯、溴、碘 | B. | 食盐、淡水 | C. | 烧碱、氢气 | D. | 钠、镁、铝 |
12.下列有关钢铁的腐蚀与防护的说法正确的是( )
| A. | 钢铁发生析氢腐蚀时,负极反应是Fe-3e-=Fe3+ | |
| B. | 钢铁发生析氧腐蚀的时候正极反应是2H2O+O2+e-═4OH- | |
| C. | 钢管与电源负极相连时,钢管可被保护 | |
| D. | 在入海口的钢铁闸门上装一定数量的铜块,可防止闸门被腐蚀 |
9.下列物质中,既存在离子键又存在非极性键的是( )
| A. | H2O2 | B. | MgCl2 | C. | CaC2 | D. | NaOH |
16.下列实施中,能说明HNO2是弱电解质的是( )
| A. | 用HNO2溶液做导电性试验,灯光较暗 | |
| B. | HNO2是共价化合物 | |
| C. | HNO2溶液不与氯化钠反应 | |
| D. | 常温下,0.1mol.L-1HNO2溶液的pH为2.15 |
6.下述实验不能能达到预期目的是( )
| 实验内容 | 实验目的 | |
| A | 向碳酸钠溶液中滴入几滴酚酞溶液 | 证明碳酸钠溶液呈碱性 |
| B | 取少量未知溶液于一只干净的试管中,向该溶液中逐渐滴入NaOH溶液直至过量 | 检验该溶液中是否含有Al3+ |
| C | 取未知溶液做焰色反应实验,并通过蓝色钴玻璃观看 | 检验该溶液中是否含有K+ |
| D | 取少量未知溶液,滴加新制的氯水,再滴加KSCN溶液 | 检验未知液中是否含Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
13.下列反应里,有机物分子中断裂的共价键是π键的是( )
| A. | 甲烷与氯气发生取代反应 | B. | 乙烯与溴水发生加成反应 | ||
| C. | 氯气与氢气反应生成氯化氢 | D. | 乙醇与乙酸的酯化反应 |
10.两种元素X、Y,其原子核外电子层数分别为a、b,最外层电子数分别为m、n.下列说法不正确的是( )
| A. | 若8>m>3,则X必定为主族元素 | |
| B. | 若a<b<m=n=4,则晶体类型相同时,其单质熔点:X>Y | |
| C. | 若Y的气态氢化物化学式为YHn,且b<4,则该氢化物为非极性分子 | |
| D. | 若a=b=3,8>m>n>b,则元素非金属性:X>Y |
11.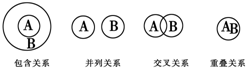 化学概念在逻辑上存在如下关系:对下列概念的说法正确的是( )
化学概念在逻辑上存在如下关系:对下列概念的说法正确的是( )
 化学概念在逻辑上存在如下关系:对下列概念的说法正确的是( )
化学概念在逻辑上存在如下关系:对下列概念的说法正确的是( )| A. | 化合物与电解质属于重叠关系 | B. | 化合物与碱性氧化物属于交叉关系 | ||
| C. | 溶液与胶体属于并列关系 | D. | 离子化合物和电解质属于交叉关系 |