题目内容
8.I.碳和氮的化合物与人类生产、生活密切相关.(1)有机物加氢反应中镍是常用的催化剂.但H2中一般含有微量CO会使催化剂镍中毒,在反应过程中消除CO的理想做法是投入少量SO2,为搞清该方法对催化剂的影响,查得资料:
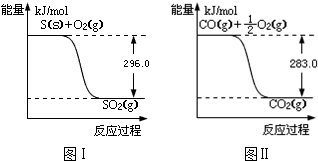
则:①不用通入O2氧化的方法除去CO的原因是避免O2与Ni反应再使其失去催化作用.
②SO2(g)+2CO(g)=S(s)+2CO2(g)△H=-270kJ/mol.
(2)汽车尾气中含大量CO和氮氧化物(NOx)等有毒气体.
①活性炭处理NO的反应:C(s)+2NO(g)?N2(g)+CO2 (g)△H=-a kJ•mol-1(a>0)若使NO更加有效的转化为无毒尾气排放,以下措施理论上可行的是b.
b
a.增加排气管长度 b.增大尾气排放口
c.添加合适的催化剂 d.升高排气管温度
②在排气管上添加三元催化转化图Ⅲ装置,CO能与氮氧化物(NOx)反应生成无毒尾气,其化学方程式是2xCO+2NOx $\frac{\underline{\;催化剂\;}}{\;}$2xCO2+N2.
Ⅱ.氮元素和碳元素一样也存在一系列氢化物并有广泛应用.例如:NH3、N2H4、N3H5、N4H6….
(1)写出该系列氢化物的通式:NnHn+2(n≥2);.
(2)已知NH3为一元碱,N2H4为二元碱,N2H4在水溶液中的一级电离方程式可表示为N2H4•H2O?N2H5++OH-,试写出N2H4的二级电离方程式:N2H5++H2O?N2H62++OH-.
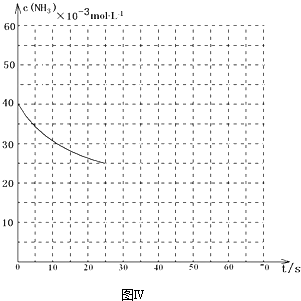
(3)用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g)△H<0某温度下,向容积为100L的密闭容器中通入4mol NH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%.该温度下此反应平衡常数K的值为2500.图中的曲线表示该反应在前25s内的反应进程中的NH3浓度变化.若反应延续至70s,保持其它条件不变情况下,请在图2中用实线画出使用催化剂时该反应的进程曲线.
分析 I.(1)①Ni能与氧气反应也会导致其中毒,据此解答即可;
②由图I可知,O2(g)+2CO(g)=2CO2(g)△H=(-2×283)kJ•mol-1=-566kJ•mol-1,(i)
由图II可知,S(s)+O2(g)=SO2(g)△H=-296kJ•mol-1,(ii)
(i)-(ii)利用盖斯定律进行计算即可;
(2)①依据此反应特点判断即可;
②根据反应物、生成物和反应条件及质量守恒定律的两个原则,写出正确的化学方程式;
Ⅱ、(1)根据氮原子和氢原子个数之间的关系确定氢化物的通式;
(2)N2H4是二元弱碱,可分别发生N2H4+H2O?N2H5++OH-、N2H5++H2O?N2H62++OH-两步电离;
(3)依据化学方程式和平衡常数概念写出表达式,注意尿素是固体;根据化学平衡三段式列式计算平衡浓度,计算平衡常数;依据催化剂的作用画出图象.
解答 解:I.(1)①Ni能与氧气反应也会导致其中毒,故答案为:避免O2与Ni反应再使其失去催化作用;
②由图I可知,O2(g)+2CO(g)=2CO2(g)△H=(-2×283)kJ•mol-1=-566kJ•mol-1,(i)
由图II可知,S(s)+O2(g)=SO2(g)△H=-296kJ•mol-1,(ii)
(i)-(ii)得:SO2(g)+2CO(g)=S(s)+2CO2(g)△H=-563-(-298)=-270kJ•mol-1,故答案为:-270kJ/mol;
(2)①C(s)+2NO(g)?N2(g)+CO2 (g)△H=-a kJ•mol-1,此反应为放热反应,且为气体体积不变的反应,a.增加排气管长度,不能改变NO的转化率,故a错误;
b.增大尾气排放口,相当于移出部分氮气和二氧化碳气体,利于平衡右移,故b正确;
c.添加合适的催化剂,只改变化学反应速率,不会增加NO的转化率,故c错误;
d.升高排气管温度,温度升高,平衡左移,不利于NO转化,故d错误;故选b;
②反应物是一氧化碳和NOx,生成物无毒,故生成物之一是氮气和二氧化碳,根据反应前后元素种类不变,化学方程式为:2xCO+2NOx $\frac{\underline{\;催化剂\;}}{\;}$2xCO2+N2,
故答案为:2xCO+2NOx $\frac{\underline{\;催化剂\;}}{\;}$2xCO2+N2;
Ⅱ、(1)根据氮原子和氢原子个数之间的关系:氢原子个数比氮原子个数多2,所以通式表示为:NnHn+2(n≥2),故答案为:NnHn+2(n≥2);
(2)N2H4是二元弱碱,可分别发生N2H4+H2O?N2H5++OH-、N2H5++H2O?N2H62++OH-,故答案为:N2H5++H2O?N2H62++OH-;
(3)2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g).依据化学方程式和平衡常数概念写出平衡常数K=$\frac{c(H{\;}_{2}O)}{c(CO{\;}_{2})c{\;}^{2}(NH{\;}_{3})}$,向容积为100L的密闭容器中通入4mol NH3和2molCO2,该反应进行到40s时达到平衡,反应达到平衡时CO2的转化率为50%,消耗二氧化碳浓度0.02mol/L×50%=0.01mol/mol;
2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g)
起始量(mol/L) 0.04 0.02 0 0
变化量(mol/L) 0.02 0.01 0 0.01
平衡量(mol/L) 0.02 0.01 0 0.01
K=$\frac{c(H{\;}_{2}O)}{c(CO{\;}_{2})c{\;}^{2}(NH{\;}_{3})}$=$\frac{0.01}{0.02{\;}^{2}×0.01}$=2500L2•mol-2
如图2中的曲线表示该反应在前25s内的反应进程中的NH3浓度变化.若反应延续至70s,保持其它条件不变情况下,在图中用实线画出使用催化剂时,改变反应速率,不改变化学平衡,该反应的进程曲线为,曲线的转折点在横坐标40之前,纵坐标必需在20的线上,如图为 ,
,
故答案为:2500; .
.
点评 本题考查了热化学方程式书写方法,化学平衡影响因素分析,弱电解质的电离等综合知识的考查,掌握基础是关键,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 分散质粒子不能透过滤纸 | B. | 具有丁达尔效应 | ||
| C. | 分散质很快就沉降下来 | D. | 所得分散系是溶液 |
| A. | T℃时,pH=6的纯水中,含有的OH-数目为1×10-6NA | |
| B. | 标准状况下,22.4LCCl4中含有的共用电子对数目为4.0NA | |
| C. | 50g98%的浓硫酸中,所含的氧原子数目为2NA | |
| D. | 1molNa2O2与足量CO2充分反应转移的电子数目为NA |
| A. | Cu2+、H+、SO42-、Cl- | B. | Na+、Ba2+、NO3-、CO32- | ||
| C. | Al3+、H+、CO32-、Cl- | D. | Ba2+、OH-、Fe2+、NO3- |
| A. | 实验室中可用燃烧法处理CO、H2、H2S等可燃性尾气 | |
| B. | 检验硫酸亚铁铵晶体中是否含有结晶水:取一试管,用药匙加入2克硫酸亚铁铵晶体,并在试管口塞上一团蘸有少量无水硫酸铜粉末的棉花,同时塞紧塞子,点燃酒精灯加热试管,观察现象 | |
| C. | 取一药匙铁粉、半药匙食盐置于一片塑料薄膜上,混合均匀,滴一滴管水,包起塑料薄膜(不包紧,有空气),用手摸立刻有发烫感 | |
| D. | 在中和滴定实验中,既可用标准溶液滴定待测液,也可用待测液滴定标准溶液 |
| A. | 各物质的浓度之比为2:3:3 | |
| B. | ν(A)、ν(B)、ν(C) 之比为2:3:3 | |
| C. | A、B、C三种物质的浓度不随时间变化而变化 | |
| D. | 混合物各物质的量浓度相等 |
| A. | m+n<p | B. | 平衡向逆反应方向移动 | ||
| C. | A的转化率降低 | D. | C的体积分数增大 |
| A. | 题述反应条件下还原性:CO>Pd | |
| B. | 题述反应中PdCl2被氧化 | |
| C. | 在标况下生成11.2 L CO2时,转移的电子为2 mo1 | |
| D. | 题述反应中CO2为氧化产物 |
| A. | 用铜电极电解氯化钙溶液:2 Cl-+2H2O═Cl2↑+H2↑+2OH- | |
| B. | 向碳酸氢钙溶液中滴入少量氢氧化钠溶液:Ca2++2 HCO3-+2OH-→CaCO3↓+2H2O+CO32- | |
| C. | 在H2O2中加入酸性KMnO4溶液:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O | |
| D. | 向偏铝酸钠溶液中加入足量的NaHSO4溶液:AlO2-+H++H2O═Al(OH)3↓ |