题目内容
20.在密闭容器中发生如下反应:mA(g)+nB(g)→pC(g),达到平衡后,保持温度不变,将气体体积压缩到原来的$\frac{1}{3}$,当达到新平衡时,C的浓度变为原来2倍,下列说法错误的是( )| A. | m+n<p | B. | 平衡向逆反应方向移动 | ||
| C. | A的转化率降低 | D. | C的体积分数增大 |
分析 mA(g)+nB(g)?pC(g),达到平衡后,温度不变,将气体体积压缩到$\frac{1}{3}$,若平衡不移动,C的浓度为原来的3倍,当达到平衡时C的浓度为原来的2倍,则体积减小时平衡逆向移动,以此来解答.
解答 解:mA(g)+nB(g)?pC(g),达到平衡后,温度不变,将气体体积压缩到$\frac{1}{3}$,若平衡不移动,C的浓度为原来的3倍,当达到平衡时C的浓度为原来的2倍,则体积减小时平衡逆向移动,
A.体积缩小,相当于加压,平衡逆向移动,则m+n<p,故A正确;
B.由上述分析可知,平衡逆向移动,故B正确;
C.平衡逆向移动,A的转化率减小,故C正确;
D.平衡逆向移动,C的体积分数减小,但比原来的大,故D错误;
故选D.
点评 本题考查影响平衡移动的因素,注意把握“体积压缩到$\frac{1}{3}$,当达到平衡时C的浓度为原来的2倍”为解答的关键信息,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.下列除杂质的方案不可行的是( )
| A. | 用饱和碳酸钠溶液除去乙酸乙醋中的乙酸和乙醇 | |
| B. | 用加人NaOH 溶液、分液的方法来分离甲苯和苯酚的混合液 | |
| C. | 用渗析的方法对蛋白质胶体进行提纯,以净化蛋白质胶体 | |
| D. | 用酸性高锰酸钾溶液除去乙烷中的乙烯 |
11.下列有关物质用途的说法正确的是( )
| A. | 明矾可用作净水剂 | B. | 甲醛可用作食品防腐剂 | ||
| C. | 氢氧化钠可用来治疗胃酸过多 | D. | 铝制容器可长期存放酸性食物 |
15.丙烷是一种重要的烷烃,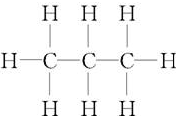 表示其( )
表示其( )
 表示其( )
表示其( )| A. | 结构简式 | B. | 结构式 | C. | 电子式 | D. | 分子式 |
5. 北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法正确的是 ( )(多项选择题)
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法正确的是 ( )(多项选择题)
 北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法正确的是 ( )(多项选择题)
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法正确的是 ( )(多项选择题)| A. | 该物质能使鲜花长期盛开 | |
| B. | 1mol该物质与NaOH溶液反应,最多消耗1mol NaOH | |
| C. | 该物质既能发生加聚反应,又能发生缩聚反应 | |
| D. | 该物质既可以与FeCl3溶液发生显色反应,又可以使酸性KMnO4溶液褪色 | |
| E. | 该物质分子式为C15H20O4 |
9.请选择适当的试剂.用以除去括号内的杂质,并写出相关的化学方程式
A.KSCN溶液 B.Fe C.氧水 D.稀盐酸 E.NaOH溶液 F.氨水
A.KSCN溶液 B.Fe C.氧水 D.稀盐酸 E.NaOH溶液 F.氨水
| 物质 | 加入试剂 | 有关化学方程式 |
| FeCl2(FeCl3)(溶液) | Fe | 2FeCl3+Fe=3FeCl2 |
| MgO(Al2O3) | NaOH溶液 | Al2O3+2NaOH═2NaAlO2+H2O |
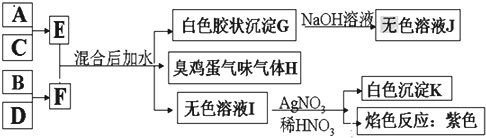
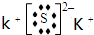 .
.