题目内容
【题目】已知在一个1L的密闭容器中放入4mol N2O5气体后会发生如下两种反应:①N2O5(g)![]() N2O3(g)+O2(g);②N2O3(g)
N2O3(g)+O2(g);②N2O3(g)![]() N2O(g)+O2(g)。在某温度下达到平衡后c(O2)=4.4mol/L,c(N2O3)=1.6mol/L。求反应中N2O5的分解率____。
N2O(g)+O2(g)。在某温度下达到平衡后c(O2)=4.4mol/L,c(N2O3)=1.6mol/L。求反应中N2O5的分解率____。
【答案】75%
【解析】
设反应①中N2O5分解了x mol,反应②中生成的N2O为y mol,根据物质反应消耗转化关系,利用三段式法计算出x、y的值,最后根据转化率=![]() ×100%计算反应中N2O5的分解率。
×100%计算反应中N2O5的分解率。
在反应①N2O5(g)![]() N2O3(g)+O2(g)中每反应1mol N2O5(g),产生1mol N2O3和1mol O2(g),N2O5(g)反应分解了x mol,则反应产生x mol N2O3和x molO2(g),①平衡时N2O5(g)的物质的量为(4-x)mol,平衡时有x mol N2O3和x molO2(g),然后发生②反应,根据N2O3(g)
N2O3(g)+O2(g)中每反应1mol N2O5(g),产生1mol N2O3和1mol O2(g),N2O5(g)反应分解了x mol,则反应产生x mol N2O3和x molO2(g),①平衡时N2O5(g)的物质的量为(4-x)mol,平衡时有x mol N2O3和x molO2(g),然后发生②反应,根据N2O3(g)![]() N2O(g)+O2(g)可知:1mol N2O3(g) 反应产生1mol N2O(g)和1mol O2(g),②反应分解了y mol,会产生y mol N2O(g)、y mol O2(g),两个反应都达到平衡时N2O3(g)的物质的量为(x-y)mol,O2的物质的量为(x+y)mol,N2O5(g)的物质的量为(4-x)mol,由于容器的容积是1L,所以c(O2)= (x+y)mol÷1L=4.4mol/L,c(N2O3)= (x-y)mol÷1L=1.6mol/L,解得x=3mol,y=1.4mol,所以N2O5(g)的分解率为
N2O(g)+O2(g)可知:1mol N2O3(g) 反应产生1mol N2O(g)和1mol O2(g),②反应分解了y mol,会产生y mol N2O(g)、y mol O2(g),两个反应都达到平衡时N2O3(g)的物质的量为(x-y)mol,O2的物质的量为(x+y)mol,N2O5(g)的物质的量为(4-x)mol,由于容器的容积是1L,所以c(O2)= (x+y)mol÷1L=4.4mol/L,c(N2O3)= (x-y)mol÷1L=1.6mol/L,解得x=3mol,y=1.4mol,所以N2O5(g)的分解率为![]() ×100%=75%。
×100%=75%。

【题目】某实验小组用软锰矿制备高锰酸钾,主要实验步骤如下:
步骤一:将软锰矿(主要成分为MnO2)、KClO3和KOH固体按一定比例混合后加热熔融可制得绿色K2MnO4;
步骤二:将反应后固体充分溶解、过滤,向滤液中通入过量CO2气体使溶液显酸性,K2MnO4在酸性条件下反应得到KMnO4、MnO2和K2CO3,最后分离得到高锰酸钾晶体(粗产品)。
请回答下列问题:
(1)步骤一加热熔融应在________(填序号)进行。
A.铁坩埚 B.氧化铝坩埚 C.瓷坩埚 D.石英
(2)为进一步提高粗产品(高锰酸钾晶体)的纯度,常采用的实验方法是_____________。
(3)KMnO4、MnO2在一定条件下都可以氧化浓盐酸制取氯气,制取等物质的量的氯气消耗KMnO4与MnO2的物质的量之比为________________。
(4)某学习小组为了探究高锰酸钾溶液和草酸钠溶液的反应过程,将高锰酸钾溶液逐滴滴入一定体积的酸性草酸钠溶液中(温度相同,并不断振荡),记录的现象如表:
滴入KMnO4溶液的次序(假设每滴溶液体积相等) | 滴入的KMnO4溶液紫色褪去的时间 |
先滴入第1滴 | 1min |
褪色后再滴入第2滴 | 15s |
褪色后再滴入第3滴 | 3s |
褪色后再滴入第4滴 | 1s |
请分析高锰酸钾溶液褪色时间变化的原因:_________。
(5)我国《室内空气质量标准》规定室内空气中甲醛(HCHO)含量不得超过0.08mg/m3。我校某同学通过查阅资料,拟采用如下方法测定2019年暑假新装修的焕然一新的明德楼教室内空气中甲醛的含量。
测定原理:5HCHO+4KMnO4+6H2SO4=2K2SO4+4MnSO4+5CO2↑+11H2O。
实验操作:用容积为1000mL用注射器抽取空气,缓慢注入酸性高锰酸钾溶液中(装置如图),当酸性高锰酸钾溶液正好褪色时,停止注入。

①用0.1000mol/L的酸性KMnO4溶液配制实验中使用的酸性KMnO4溶液l000mL,需0.1000mol/L的酸性KMnO4溶液的体积为___________。
②装置中多孔玻璃球泡的作用是__________。
③该同学在206教室内不同地点抽取空气,并缓慢注入酸性高锰酸钾溶液中。当第250次将注射器中空气全部缓慢注入酸性高锰酸钾溶液中时,酸性高锰酸钾溶液恰好褪色。请通过计算判断,该教室空气中甲醛含量________(填“已”或“未”)超标。若未超标,该教室内空气中甲醛(HCHO)含量为________mg/m3;若已超标,请举出减少室内空气污染的一条合理措施:_________________。
【题目】氧化锌是一种无毒的无机化合物,可用于生产婴儿爽身粉。锌焙砂主要含ZnO、ZnFe2O4,还含有少量Al2O3、FeO、Fe2O3、CuO、SiO2等氧化物。如图是工业上利用锌焙砂制取氧化锌的流程图。
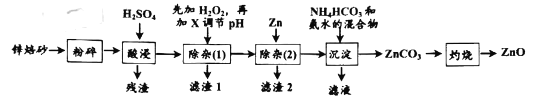
已知:几种常见金属离子形成氢氧化物沉淀时的pH值如下表:
氢氧化物 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 | Zn(OH)2 |
开始沉淀pH | 7.0 | 2.7 | 3.7 | 4.2 | 6.4 |
完全沉淀pH | 9.2 | 3.2 | 5.2 | 6.7 | 8.0 |
回答下列问题:
(1)ZnFe2O4中铁的化合价是__,H2O2的电子式为___。
(2)“酸浸”时ZnFe2O4会生成两种盐,该反应的化学方程式为__。
(3)“除杂(1)”是为了除去浸出液中的Fe3+、Fe2+、Al3+,加入H2O2溶液的目的是(用离子方程式表示)__,为了加快反应速率,可适当加热。加入的H2O2溶液比预计的要多了许多,原因是:__;需要调节的pH的范围是__,所加的试剂X是__(填化学式)
(4)“沉淀”时,需要控制温度在40℃,目的是:__。
(5)“滤液”中溶质的主要成份是__(写化学式)。