题目内容
【题目】硫化汞(HgS)难溶于水,在自然界中呈红褐色,常用于油画颜料,印泥及朱红雕刻漆器等。某温度时,HgS在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
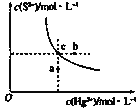
A.向硫化汞的浊液中加入硫化钠溶液,硫化汞的Ksp减小
B.图中a点对应的是饱和溶液
C.向c点的溶液中加入Hg(NO3)2,则c(S2-)减小
D.升高温度可以实现c点到b点的转化
【答案】C
【解析】
曲线上的点均为饱和溶液中的浓度,有Ksp= c(S2-) c(Hg2+),曲线下方的点表示的为HgS的稀溶液,曲线上方的点表示的HgS的过饱和溶液。
A、Ksp只受温度影响,A项错误;
B、c点是饱和溶液,a点未达到饱和,B项错误;
C、向饱和溶液中加入Hg(NO)3溶液,c(Hg2+)增大,HgS(s)![]() Hg2+(aq)+S2-(aq)平衡左移,c(S2-)减小,C项正确;
Hg2+(aq)+S2-(aq)平衡左移,c(S2-)减小,C项正确;
D、升高温度,平衡右移,c(Hg2+)、c(S2-)均增大,而c点到b点c(S2-)未变,D项错误;
答案选C。

 智慧小复习系列答案
智慧小复习系列答案【题目】下列实验方案不能达到相应目的的是
A | B | C | D | |
目的 | 比较碳酸根与碳酸氢根水解程度 | 研究浓度对化学平衡的影响 | 比较不同催化剂对化学反应速率的影响 | 比较碳酸、醋酸和硼酸的酸性强弱 |
实验方案 |
|
|
|
|
A. AB. BC. CD. D
【题目】近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。
(1)已知:CO2(g)+H2(g) H2O(g) +CO(g) ΔH1 = + 41.1 kJmol-1
CO(g)+2H2(g) CH3OH(g) ΔH2=-90.0 kJmol-1
写出CO2催化氢化合成甲醇的热化学方程式:___________________________________________。
(2)为提高CH3OH产率,理论上应采用的条件是_______(填字母)。
a.高温高压 b.低温低压 c.高温低压 d.低温高压
(3)250℃、在恒容密闭容器中由CO2(g)催化氢化合成CH3OH(g),下图为不同投料比[n(H2)/n(CO2)]时某反应物X平衡转化率变化曲线。
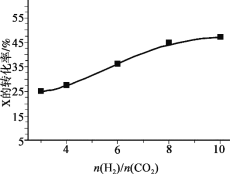
反应物X是_______(填“CO2”或“H2”)。
(4)250℃、在体积为2.0L的恒容密闭容器中加入6mol H2、2mol CO2和催化剂,10min时反应达到平衡,测得c(CH3OH) = 0.75 mol· L-1。
①化学平衡常数K = _______。
②催化剂和反应条件与反应物转化率和产物的选择性有高度相关。控制相同投料比和相同反应时间,四组实验数据如下:
实验编号 | 温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
A | 543 | Cu/ZnO纳米棒 | 12.3 | 42.3 |
B | 543 | Cu/ZnO纳米片 | 11.9 | 72.7 |
C | 553 | Cu/ZnO纳米棒 | 15.3 | 39.1 |
D | 553 | Cu/ZnO纳米片 | 12.0 | 70.6 |
根据上表所给数据,用CO2生产甲醇的最优选项为_______(填字母)。
【题目】以下是25℃时几种难溶电解质的溶解度:
难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子。例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,加入一定量的试剂反应,过滤结晶。
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶。
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶。
请回答下列问题:
(1)上述三个除杂方案都能够达到很好的效果,Fe2+、Fe3+都被转化为____而除去。
(2)①中加入的试剂应该选择______为宜,其原因是______。
(3)②中除去Fe3+所发生的总反应的离子方程式为_____。
(4)下列与方案③相关的叙述中,正确的是_____(填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在