题目内容
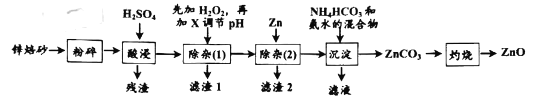
【题目】氧化锌是一种无毒的无机化合物,可用于生产婴儿爽身粉。锌焙砂主要含ZnO、ZnFe2O4,还含有少量Al2O3、FeO、Fe2O3、CuO、SiO2等氧化物。如图是工业上利用锌焙砂制取氧化锌的流程图。
已知:几种常见金属离子形成氢氧化物沉淀时的pH值如下表:
氢氧化物 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 | Zn(OH)2 |
开始沉淀pH | 7.0 | 2.7 | 3.7 | 4.2 | 6.4 |
完全沉淀pH | 9.2 | 3.2 | 5.2 | 6.7 | 8.0 |
回答下列问题:
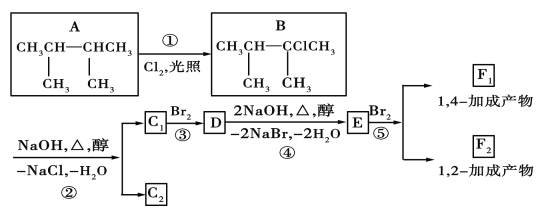
(1)ZnFe2O4中铁的化合价是__,H2O2的电子式为___。
(2)“酸浸”时ZnFe2O4会生成两种盐,该反应的化学方程式为__。
(3)“除杂(1)”是为了除去浸出液中的Fe3+、Fe2+、Al3+,加入H2O2溶液的目的是(用离子方程式表示)__,为了加快反应速率,可适当加热。加入的H2O2溶液比预计的要多了许多,原因是:__;需要调节的pH的范围是__,所加的试剂X是__(填化学式)
(4)“沉淀”时,需要控制温度在40℃,目的是:__。
(5)“滤液”中溶质的主要成份是__(写化学式)。
【答案】+3 ![]() ZnFe2O4+4H2SO4=ZnSO4+Fe2(SO4)3+4H2O 2Fe2++H2O2+2H+=2Fe3++2H2O 温度过高和反应生成的Fe3+的催化作用均加速率H2O2的分解 5.2≤pH<6.4 ZnO[或ZnCO3、Zn(OH)2等] 防止NH4HCO3分解,NH3·H2O挥发 (NH4)2SO4
ZnFe2O4+4H2SO4=ZnSO4+Fe2(SO4)3+4H2O 2Fe2++H2O2+2H+=2Fe3++2H2O 温度过高和反应生成的Fe3+的催化作用均加速率H2O2的分解 5.2≤pH<6.4 ZnO[或ZnCO3、Zn(OH)2等] 防止NH4HCO3分解,NH3·H2O挥发 (NH4)2SO4
【解析】
根据流程图知,锌焙砂粉碎后酸浸后得到的溶液中溶质主要为硫酸铁、硫酸亚铁、硫酸锌、硫酸铜、和硫酸铝,残渣为未反应的二氧化硅,除杂(1)主要除去氢氧化铁、氢氧化铝和部分氢氧化铜沉淀;加入锌置换出溶液中的Cu2+,此时溶液中的阳离子为Zn2+,阴离子为SO42-,再加入碳酸氢铵和氨水的混合物,反应得到碳酸锌沉淀,据此分析解答。
(1)ZnFe2O4中Zn为+2价,O为-2价,根据化合物中元素化合价代数和为0分析,铁的化合价是+3;H2O2属于共价分子,其电子式为![]() ,故答案为:+3;
,故答案为:+3;![]() ;
;
(2)ZnFe2O4中含有锌离子和铁离子,所以与酸反应生成硫酸锌和硫酸铁,化学方程式为:ZnFe2O4+4H2SO4=ZnSO4+Fe2(SO4)3+4H2O,故答案为:ZnFe2O4+4H2SO4=ZnSO4+Fe2(SO4)3+4H2O;
(3)加入H2O2溶液的目的是将Fe2+氧化为Fe3+,更容易完全沉淀,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;根据题给信息分析知,加入过多的H2O2原因是:温度过高和反应生成的Fe3+的催化作用均加速率H2O2的分解;根据题给数据分析,pH=5.2时,铁离子、铝离子完全沉淀,pH=6.4时,锌离子开始沉淀,所以需要调节的pH的范围是5.2≤pH<6.4,为了保证不引入新的杂质,所加的试剂X是ZnO[或ZnCO3、Zn(OH)2等],故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;温度过高和反应生成的Fe3+的催化作用均加速率H2O2的分解;5.2≤pH<6.4;ZnO[或ZnCO3、Zn(OH)2等];
(4)“沉淀”时,加入的NH4HCO3受热易分解,且NH3·H2O挥发,故答案为:防止NH4HCO3分解,NH3·H2O挥发;
(5)根据流程分析,溶液中存在NH4+和SO42-,所以“滤液”中溶质的主要成份是(NH4)2SO4,故答案为:(NH4)2SO4。