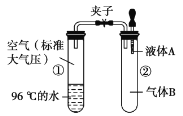
题目内容
【题目】已知Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+,进行以下实验,记录实验结果,并思考改变物质浓度对平衡移动的影响。
2CrO42-(黄色)+2H+,进行以下实验,记录实验结果,并思考改变物质浓度对平衡移动的影响。
实验1:向试管中加入4mL 0.1mol·L-1 K2Cr2O7溶液,再加数滴1mol·L-1 NaOH溶液,观察溶液颜色变化;
实验2:将上述溶液分成两份向其中一份中滴加1mol·L-1 HNO3,观察溶液颜色变化,并和另一份做对比_____。
实验现象 | 实验结论 | |
实验1 | ||
实验2 |
【答案】
实验现象 | 实验结论 | |
实验1 | 溶液的黄色加深 | 减小生成物浓度,平衡向正反应方向移动 |
实验2 | 溶液的橙色加深 | 增大生成物浓度,平衡向逆反应方向移动 |
【解析】
加入NaOH溶液,发生H++OH-=H2O,使生成物H+浓度降低;加入HNO3,导致H+浓度增大;然后利用改变物质浓度对化学平衡移动的影响,结合Cr2O72-显橙色,CrO42-显黄色分析判断溶液颜色变化。
在K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+,
2CrO42-(黄色)+2H+,
实验1:向试管中加入4mL 0.1mol·L-1 K2Cr2O7溶液,再加数滴1mol·L-1 NaOH溶液,NaOH会中和可逆反应产生的H+,使溶液中c(H+)减小,减小生成物浓度,平衡正向移动,导致溶液的黄色物质增多,溶液的黄色加深;
实验2:将上述溶液分成两份向其中一份中滴加1mol·L-1 HNO3,硝酸电离产生H+,使溶液中c(H+)增大,增大生成物浓度,平衡逆向移动,导致溶液的橙色物质增多,溶液的橙色加深。

【题目】有机物A可由葡萄糖发酵得到,也可以从牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
称取A9.0g,升温使其汽化,测其密度是相同条件下H2的45倍 | 试通过计算填空: (1)A的相对分子质量为__。 |
将9.0gA在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g | (2)A的分子式为__。 |
另取A9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 | (3)用结构简式表示A中含有的官能团__、__。 |
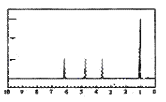
A的核磁共振氢谱如图:
| (4)A中含有__种氢原子。 综上所述,A的结构简式为__。 |