��Ŀ����
����Ŀ��ʵ�����Ʊ��������ķ�Ӧԭ����ʵ��װ��(����װ����)���£�![]() +HO��NO2
+HO��NO2![]()
![]() +H2O
+H2O
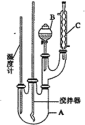
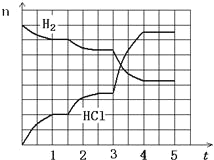
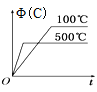
�����й�˵����ȷ����
A.��Ӧ��������ȴ�����µ����Һ©���С�������ˮ��5%��NaOH��Һ��ˮϴ�ӣ�Ȼ�����CaCl2������ˣ��ɵõ��ߴ��ȵ���������
B.�ñ�������Ҳ�����Ʊ��屽
C.װ��C��������������������������ˮ��C���¿�����
D.����������������ɫ�ģ���ʵ�������������ʻ�ɫ����Ҫ�������ܽ��˱�
���𰸡�B
��������
Aװ���з�������������Ũ�����������������·�����Ӧ������������ˮ��B��ʢ����ȴ���Ũ����Ũ�������ᣬ�μ���A�У��������ᷢ��ȡ����Ӧ�õ���������ˮ��cΪ�����ܣ���������������������ȴ�����µ����Һ©���С�������ˮ��5%��NaOH��Һ��ˮϴ�ӣ�Ȼ����������ƿ����ȥCaCl2�������������ռ�205��210����֣��õ������������ݴ˷�����
A������ˮϴ��ȥŨ���ᡢ���ᣬ�����������Ƴ�ȥ�ܽ�������ᣬ���ˮϴ��ȥδ��Ӧ��NaOH�����ɵ��Σ�Ȼ����������ƿ����ȥCaCl2�������������ռ�205��210����֣��õ�������������A����
B���屽�����ñ���Һ�������廯���Ĵ������·���ȡ����Ӧ�����屽���廯�⣬�ñ�������Ҳ�����Ʊ��屽����B��ȷ��
C��װ��C�����������ܣ�����������������������������ˮ��C���¿����룬�Ͽ���������C����
D���������ʻ�ɫ����Ҫ������������Ũ���ᣬŨ���������ֽ⣬����Ũ����ֽ������NO2(������)�����ʶ��ʻ�ɫ���������ܽ��˱�����D����
��ѡB��

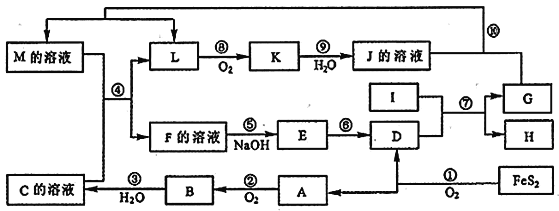
����Ŀ����ͭ�ǹ㷺Ӧ�������������Ԫ�������úϽ�ij����С���ij�Ͼ���ͭԪ��(��25%BeO��71%CuS������FeS��SiO2)�л������ͭ���ֽ����Ĺ����������£�
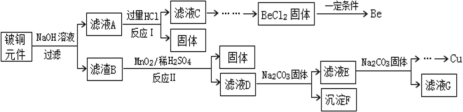
��֪��I���롢��Ԫ�ػ�ѧ�������ƣ�BeCl2����ʱ�������룻
���������²�����������ܶȻ��������±���
������ | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 |
�ܶȻ�����(Ksp) | 2.2��10��20 | 4.0��10��38 | 2.1��10��13 |
(1)��ҺA����Ҫ�ɷֳ�NaOH�⣬����___________(�ѧʽ)��д����ӦI�к��뻯������������ᷴӦ�����ӷ���ʽ��__________��
(2)����ҺC�к�NaCl��BeCl2������HCl��Ϊ�ᴿBeCl2���������ʵ�鲽��˳��Ϊ_______(����ĸ)
a.��������İ�ˮ b.ͨ�������CO2 c.���������NaOH d.����������HCl e.ϴ�� f.����
�ڴ�BeCl2��Һ�л��BeCl2�ľ����״��ᾧˮ�����ǽ�BeCl2������SOCl2(��ˮ�⣬����֮һ��ʹƷ����ɫ)��Ͽɵ���ˮBeCl2�����ƽ���ƶ��ǶȽ���ԭ��__________��
(3)MnO2�ܽ����������е���Ԫ������Ϊ���ʣ�д����Ӧ����CuS������Ӧ�Ļ�ѧ����ʽ��______��
(4)��ҺD��c(Cu2+)=2.2mol��L-1��c(Fe3+)=0.0080mol��L-1��c(Mn2+)=0.010mol��L-1������ͨ��������pH�ɽ������η���(����仯���Բ���)����Cu2+ǡ����ȫ����(c(Cu2+)=1.0��10-5 mol��L-1)ʱ����Һ��c(Cu2+)/ c(Fe3+)ԼΪ______��(![]() ��4.7��������λ��Ч����)
��4.7��������λ��Ч����)
(5)���NaCl��BeCl2������ο��Ʊ������롣
�ٵ������У������Ȼ��Ƶ�Ŀ����________��
�ڵ��õ���Be������Լ��1%��Na������ȥBe������Na�ķ���Ϊ________����֪�������ʵ��۷е����±���
���� | �۵�(K) | �е�(K) |
Be | 1551 | 3243 |
Na | 370 | 1156 |