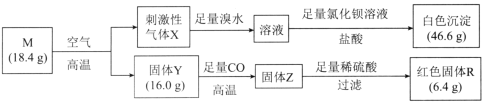
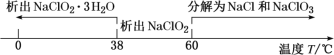题目内容
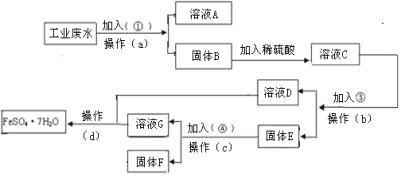
【题目】铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某废旧铍铜元件(含25%BeO、71%CuS、少量FeS和SiO2)中回收铍和铜两种金属的工艺流程如下:
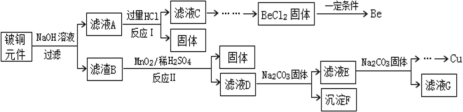
已知:I、铍、铝元素化学性质相似;BeCl2熔融时能微弱电离;
Ⅱ、常温下部分难溶物的溶度积常数如下表:
难溶物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 |
溶度积常数(Ksp) | 2.2×10—20 | 4.0×10—38 | 2.1×10—13 |
(1)滤液A的主要成分除NaOH外,还有___________(填化学式),写出反应I中含铍化合物与过量盐酸反应的离子方程式:__________。
(2)①滤液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,最合理的实验步骤顺序为_______(填字母)
a.加入过量的氨水 b.通入过量的CO2 c.加入过量的NaOH d.加入适量的HCl e.洗涤 f.过滤
②从BeCl2溶液中获得BeCl2的晶体易带结晶水,但是将BeCl2晶体与SOCl2(易水解,产物之一能使品红褪色)混合可得无水BeCl2,请从平衡移动角度解释原因:__________。
(3)MnO2能将金属硫化物中的硫元素氧化为硫单质,写出反应Ⅱ中CuS发生反应的化学方程式:______。
(4)滤液D中c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.0080mol·L-1、c(Mn2+)=0.010mol·L-1,缓慢通氨气调节pH可将其依次分离(体积变化忽略不计)。当Cu2+恰好完全沉淀(c(Cu2+)=1.0×10-5 mol·L-1)时,溶液中c(Cu2+)/ c(Fe3+)约为______。(![]() ≈4.7,保留两位有效数字)
≈4.7,保留两位有效数字)
(5)电解NaCl-BeCl2混合熔盐可制备金属铍。
①电解过程中,加入氯化钠的目的是________。
②电解得到的Be蒸气中约含1%的Na蒸气除去Be中少量Na的方法为________。已知部分物质的熔沸点如下表:
物质 | 熔点(K) | 沸点(K) |
Be | 1551 | 3243 |
Na | 370 | 1156 |
【答案】Na2BeO2、Na2SiO3 ![]() +4H+=Be2++2H2O afed SOCl2+H2O=SO2+HCl,SOCl2能吸收水,同时水解能产生HCl,抑制BeCl2的水解 MnO2+CuS+2H2SO4=MnSO4+S+CuSO4+2H2O 2.6×1010 增强熔融物的导电性 可以控制温度1156—3243K之间冷却
+4H+=Be2++2H2O afed SOCl2+H2O=SO2+HCl,SOCl2能吸收水,同时水解能产生HCl,抑制BeCl2的水解 MnO2+CuS+2H2SO4=MnSO4+S+CuSO4+2H2O 2.6×1010 增强熔融物的导电性 可以控制温度1156—3243K之间冷却
【解析】
由流程可知,铍铜元件经氢氧化钠溶液溶解后,BeO转化为铍酸钠溶液、二氧化硅转化为硅酸钠溶液,过滤后向滤液中加入过量的盐酸,硅酸钠转化为硅酸沉淀,铍酸钠转化为氯化铍溶液,再过滤,从滤液中分离出氯化铍,最后转化为铍;第一次过滤后的滤渣B为CuS、FeS,加入二氧化锰、硫酸反应,其中的铜元素和铁元素转化为硫酸铜溶液和硫酸铁,过虑后的滤液D中加碳酸钠调节pH可以依次分离出氢氧化铁和氢氧化铜,氢氧化铜最后经一系列操作得到铜,以此解答该题。
(1) 滤液A的主要成分除NaOH外,还有Na2BeO2、Na2SiO3,反应I中含铍化合物与过量盐酸反应的离子方程式为BeO22-+4H+=Be2++2H2O;
(2)①滤液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,可先加入过量的氨水生成Be(OH)2,过滤,洗涤后再加入盐酸,可生成BeCl2,操作为afed;
②已知SOCl2易水解,产物之一能使品红褪色,发生的反应为SOCl2+H2O=SO2+HCl,则SOCl2能吸收水,同时水解能产生HCl,抑制BeCl2的水解;
(3)MnO2能将金属硫化物中的硫元素氧化为硫单质,则CuS发生反应的化学方程式为为MnO2+CuS+2H2SO4═MnSO4+S+CuSO4+2H2O;
(4)已知Ksp[Cu(OH)2]= 2.2×10-20,当Cu2+恰好完全沉淀(c(Cu2+)=1.0×10-5mol·L-1)时,c(OH-)=![]() mol/L;则根据Ksp[Fe(OH)3]= 4.0×10-38,可知溶液中c(Fe3+)=
mol/L;则根据Ksp[Fe(OH)3]= 4.0×10-38,可知溶液中c(Fe3+)=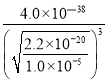 mol/L,故溶液中
mol/L,故溶液中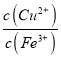 =
=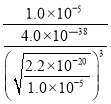 =2.6×1010;
=2.6×1010;
(5) ①熔融的NaCl能导电,则电解过程中,加入氯化钠能增强熔融物的导电性;
②电解得到的Be蒸气中约含1%的Na蒸气,由表中熔沸点可知,除去Be中少量Na的方法为可以控制温度1156K~3 243K之间冷却。

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案