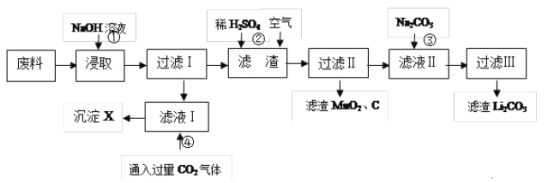
题目内容
【题目】工业上高纯硅可以通过下列反应制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g)-236kJ,完成下列填空:
Si(s)+4HCl(g)-236kJ,完成下列填空:
(1)在一定温度下进行上述反应,若反应容器的容积为 2L,经 3min 后达到平衡,获得固体的质量 8.4 g,则用 H2 表示的平均反应速率为_________。
(2)该反应的平衡常数表达式 K=_________,若欲使 K 增大,可采取的措施是_________。
(3)一定条件下,在密闭恒容容器中,能表示上述反应一定达到化学平衡状态的是_________。
a.2v 逆(SiCl4)=v 正(H2) b.断开 4mol Si-Cl 键的同时,生成 4mol H-Cl 键
c.混合气体密度保持不变 d.c(SiCl4):c(H2):c(HCl)=1:2:4
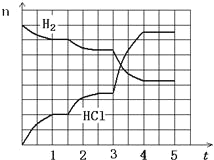
(4)若反应过程如图所示,纵坐标表示氢气、氯化氢的物质的量(mol),横坐标表示时间(min),若整个反应过程没有加入或提取各物质,则第 1.5 分钟v(正) ____ v(逆)(填><或=),第 3 分钟改变的条件是_______,各平衡态中氢气转化率最小的时间段是_______。
【答案】0.1 mol/(L·min) 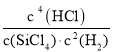 升温 ac > 升温 1-1.5min
升温 ac > 升温 1-1.5min
【解析】
(1)根据反应SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),获得固体的质量 8.4 g,该固体为硅单质,即生成
Si(s)+4HCl(g),获得固体的质量 8.4 g,该固体为硅单质,即生成![]() =0.3mol硅单质需要氢气0.6mol,则用 H2 表示的平均反应速率为
=0.3mol硅单质需要氢气0.6mol,则用 H2 表示的平均反应速率为 =0.1 mol/(L·min),
=0.1 mol/(L·min),
答案为:0.1 mol/(L·min);
(2)根据反应SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g) -236kJ,据化学方程式和平衡常数的概念计算得到平衡常数K=
Si(s)+4HCl(g) -236kJ,据化学方程式和平衡常数的概念计算得到平衡常数K=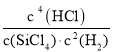 ;反应是吸热反应升温反应正向进行,平衡常数增大,
;反应是吸热反应升温反应正向进行,平衡常数增大,
答案为: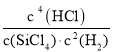 ;升温;
;升温;
(3)在密闭恒容容器中,SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g)
Si(s)+4HCl(g)
a.依据化学反应速率之比等于化学方程式系数之比,2v正(SiCl4)=v正(H2)所以 2v逆(SiCl4)=v正(H2)说明四氯化硅正逆反应速率相同,证明反应达到平衡,故a正确;
b.断开4mol Si-Cl键的同时,生成4mol H-Cl键,表示的是反应正向进行,故b错误;
c.正向进行气体质量减小,气体体积不变,混合气体密度保持不变,证明反应达到平衡,故c正确;
d.c(SiCl4):c(H2):c(HCl)=1:2:4,反应过程中符合化学方程式的系数之比,不能判断反应达到平衡,故d错误;
故答案为:ac;
(4)分析图象可知第1.5分钟,氢气减小,氯化氢增大,改变的条件是减少压强平衡正向进行,v(正) >v(逆);第3分钟曲线变化斜率大,反应速率大,反应正向进行,反应是吸热反应,改变的条件是升温;由图像可得,1-1.5min,平衡不移动,氢气转化率最小,
故答案为:>,升温,1-1.5min;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案