题目内容
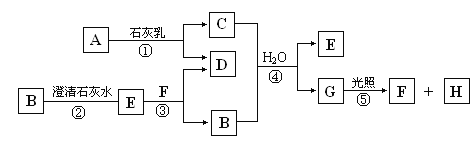
【题目】下图是无机物A到M在一定条件下的转化关系(部分产物及反应条件未列出)。其中, I 是由第三周期元素组成的单质中,熔点最高的金属。K是一种红棕色气体。

请回答下列问题
(1)M、F、E、G 四种物质中所含同一种元素,其名称是_____________。
(2)写出反应⑩(溶液 J + G)的离子反应方程式__________________________________。
(3)反应④中被还原的离子和被氧化的离子的物质的量之比是___________。
(4)向M的溶液中直接滴加 NaOH 溶液,现象是______________________,写出相应的化学方程式_____________________________,_______________________________。
(5)将化合物 D 与 KNO3、KOH 共融,可制得一种“绿色”环保高效净水剂 K2FeO4(高铁酸钾),同时还生成 KNO2 和 H2O 。该反应的的化学方程式是___________________________。
(6)共有120 t 硫铁矿(FeS2)参与反应①冶炼化合物D,最终得到化合物D共16 t,则冶炼D的转化率为_____。
【答案】铁 3Fe + 8H+ + 2NO3 = 3Fe2+ + 2NO↑+ 4H2O 1:3 先产生白色沉淀,很快变为灰绿色,最终变成红褐色 Fe(NO3)2 + 2 NaOH = Fe(OH)2↓+ 2NaNO3 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 Fe2O3 +3KNO3 + 4KOH ![]() 2K2FeO4 + 3KNO2 + 2H2O 20%
2K2FeO4 + 3KNO2 + 2H2O 20%
【解析】
FeS2氧化得到二氧化硫和氧化铁,A可以继续被氧化,则A为SO2,B为SO3,C为H2SO4,D为Fe2O3;I为第三周期中熔点最高的金属单质,I为Al,则反应⑦为铝单质与氧化铁发生的铝热反应,得到Fe与氧化铝;K是一种红棕色气体,则K为NO2,J为HNO3,J与G反应得到L,L被氧化成为NO2,则G为Fe,H为Al2O3,L为NO,联系反应④:M+H2SO4 →F+NO知,M为Fe(NO3)2,F为铁盐溶液,E为Fe(OH)3,据此分析解答。
FeS2氧化得到二氧化硫和氧化铁,A可以继续被氧化,则A为SO2,B为SO3,C为H2SO4,D为Fe2O3;I为第三周期中熔点最高的金属单质,I为Al,则反应⑦为铝单质与氧化铁发生的铝热反应,得到Fe与氧化铝;K是一种红棕色气体,则K为NO2,J为HNO3,J与G反应得到L,L被氧化成为NO2,则G为Fe,H为Al2O3,L为NO,联系反应④:M+H2SO4 →F+NO知,M为Fe(NO3)2,F为铁盐溶液,E为Fe(OH)3。
(1)M、F、E、G 四种物质中所含同一种元素,为Fe,其名称是铁,故答案为:铁;
(2)反应⑩为铁与硝酸反应生成硝酸亚铁和一氧化氮,反应的离子反应方程式为3Fe + 8H+ + 2NO3 = 3Fe2+ + 2NO↑+ 4H2O,故答案为:3Fe + 8H+ + 2NO3 = 3Fe2+ + 2NO↑+ 4H2O;
(3)反应④为硝酸亚铁与硫酸发生的氧化还原反应,反应中被还原的离子为硝酸根离子,反应生成NO,转移3个电子,被氧化的离子为亚铁离子,反应生成铁离子,转移1个电子,根据得失电子守恒,被还原的硝酸根离子和被氧化的亚铁离子的物质的量之比是1∶3,故答案为:1∶3;
(4)向M(硝酸亚铁)的溶液中直接滴加 NaOH 溶液,可以看到的现象为先产生白色沉淀,很快变为灰绿色,最终变成红褐色,相应的化学方程式有Fe(NO3)2 + 2 NaOH = Fe(OH)2↓+ 2NaNO3、4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3,故答案为:先产生白色沉淀,很快变为灰绿色,最终变成红褐色;Fe(NO3)2 + 2 NaOH = Fe(OH)2↓+ 2NaNO3;4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3;
(5)化合物Fe2O3与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O,反应的化学方程式为:Fe2O3+3KNO3+4KOH ![]() 2K2FeO4+3KNO2+2H2O,故答案为:Fe2O3+3KNO3+4KOH
2K2FeO4+3KNO2+2H2O,故答案为:Fe2O3+3KNO3+4KOH ![]() 2K2FeO4+3KNO2+2H2O;
2K2FeO4+3KNO2+2H2O;
(6)120 t 硫铁矿(FeS2)中含有铁元素120 t×![]() =56t,完全转化为氧化铁能够生成氧化铁的质量为56t×
=56t,完全转化为氧化铁能够生成氧化铁的质量为56t×![]() =80t,因此冶炼氧化铁的转化率=
=80t,因此冶炼氧化铁的转化率=![]() ×100%=20%,故答案为:20%。
×100%=20%,故答案为:20%。

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案