题目内容
11.某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图甲所示的实验装置(支撑用的铁架台省略),按要求回答问题.(B中装的是无水硫酸铜)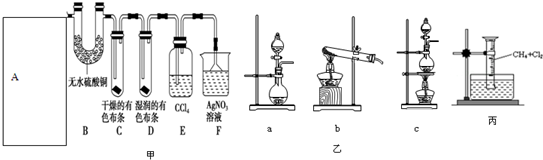
(1)A是氯气发生装置,实验室制取Cl2的原理是MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O(用化学方程式表示).
(2)该实验中图甲A部分的装置是(图乙)c(填字母).
(3)若用含有0.2mol HCl的浓盐酸与足量的氧化剂反应制Cl2,制得的Cl2体积(标准状况下)总是小于1.12L的原因是浓盐酸浓度随反应的进行变稀以后,将不再反应.
(4)装置E的作用是吸收氯气.
(5)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种.为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置.该装置中应放入湿润的淀粉KI试纸(或湿润的有色布条)试剂.
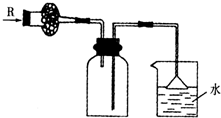
(6)用如图丙所示装置,收集一试管甲烷和氯气的混合气体,光照后观察到量筒内形成一段水柱,认为有氯化氢生成.
①该反应的反应类型为取代反应;
②水槽中盛放的液体应为C(填标号);
A.水 B.饱和石灰水 C.饱和食盐水 D.饱和NaHCO3溶液
③若1mol CH4与Cl2发生取代反应,待反应完成后测得四种取代产物的物质的量相等,则消耗的Cl2为2.5mol.
分析 实验室用浓盐酸与二氧化锰加热反应制取氯气,探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,及氯气的性质,依据反应物状态和反应条件确定发生装置,利用无水硫酸铜检验水的存在,氯气不具有漂白性,依次通过干燥有色布条、湿润有色布条,证明有漂白性的为次氯酸,不是氯气,为检验氯化氢的存在,选用硝酸银溶液,为排除氯气的干扰应用四氯化碳吸收氯气,用湿润淀粉碘化钾试液确认氯气是否吸收完全,产生白色沉淀即可证明氯化氢存在.
(1)实验室用二氧化锰与浓盐酸加热制备氯气;
(2)依据反应物状态与反应条件选择发生装置;
(3)二氧化锰只能与浓盐酸反应,与稀盐酸不反应;
(4)依据氯气易溶于有机溶剂解答;
(5)依据氯气的检验方法解答;
(6)①氯气与甲烷在光照条件下发生取代反应;
②水槽中的液体必须满足:氯气在该溶液中溶解度很小,以便证明氯气与甲烷发生了反应;
③根据碳原子守恒判断四种有机物的物质的量,发生取代反应时甲烷消耗的H原子和氯气的物质的量之比为1:1,据此计算总共消耗的氯气的物质的量.
解答 解:实验室用浓盐酸与二氧化锰加热反应制取氯气,探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,及氯气的性质,依据反应物状态和反应条件确定发生装置,利用无水硫酸铜检验水的存在,氯气不具有漂白性,依次通过干燥有色布条、湿润有色布条,证明有漂白性的为次氯酸,不是氯气,为检验氯化氢的存在,选用硝酸银溶液,为排除氯气的干扰应用四氯化碳吸收氯气,用湿润淀粉碘化钾试液确认氯气是否吸收完全,产生白色沉淀即可证明氯化氢存在.
(1)二氧化锰与浓盐酸反应生成氯化锰、氯气和水,化学方程式:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O;
(2)依据方程式MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O,反应物为固体与液体,反应条件为加热,应选择装置C;
故答案为:c;
(3)二氧化锰只能与浓盐酸反应,与稀盐酸不反应,浓盐酸浓度随反应的进行变稀以后,将不再反应;
故答案为:浓盐酸浓度随反应的进行变稀以后,将不再反应;
(4)氯气易溶于四氯化碳溶液,可用来吸收氯气;
故答案为:吸收氯气;
(5)氯气具有强的氧化性能够使湿润的淀粉KI试纸变蓝;氯气与水反应生成的次氯酸具有漂白性,能够使有色布条褪色;
故答案为:湿润的淀粉KI试纸(或湿润的有色布条);
(6)①甲烷为饱和烷烃,与氯气发生取代反应;
故答案为:取代反应;
②Cl2+H2O?H++Cl-+HClO,氯气在饱和氯化钠溶液中的溶解度较小,所以防止氯气和水反应,水槽中盛放的液体最好为饱和食盐水;由于氯气在水中溶解度较大、氯水能够与饱和石灰水、饱和碳酸氢钠溶液反应,干扰的实验结果,而不能使用水,更不能使用饱和石灰水、饱和碳酸氢钠溶液,
故答案为:C;
③1mol CH4与Cl2发生取代反应,待反应完成后测得4种取代物物质的量相等,则CH3Cl、CH2Cl2、CHCl3、CCl4的物质的量都是0.25mol,CH4与Cl2发生取代反应时消耗的氢原子和氯气的物质的量之比是1:1,
生成0.25molCH3Cl需要Cl2的物质的量为0.25mol,
生成0.25molCH2Cl2需要Cl2的物质的量为0.25mol×2=0.5mol,
生成0.25molCHCl3需要Cl2的物质的量为0.25mol×3=0.75mol,
生成0.25molCCl4需要Cl2的物质的量为0.25mol×4=1mol,
所以总共消耗的氯气的物质的量=(0.25+0.5+0.75+1)mol=2.5mol,
故答案为:2.5.
点评 本题考查了氯气的制备及性质检验,熟悉氯气制备原理及甲烷与氯气发生反应的过程是解题关键,题目难度不大.

| A. | CH4 | B. | NH3 | C. | HCl | D. | O2 |
| A. | 水与冰 | B. | CH4和CH3CH3 | C. | 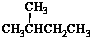 与 与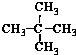 | D. | 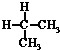 与 与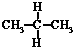 |
| A. | 11.2 LNH3中所含的质子数为5NA | |
| B. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA个 | |
| C. | 2.4g金属镁变为Mg2+时失去的电子数为0.1 NA | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为 NA 个 |
| A. | V(逆)>V(正) | B. | V(逆)<V(正) | ||
| C. | V(逆)>V(正),正逆反应停止 | D. | V(逆)=V(正),正逆反应仍进行 |
 金属冶炼和处理常涉及氧化还原反应.
金属冶炼和处理常涉及氧化还原反应.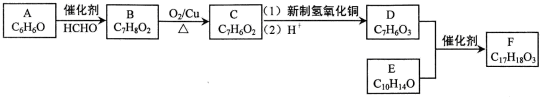
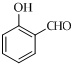 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2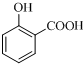 ;
;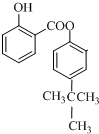 ;
;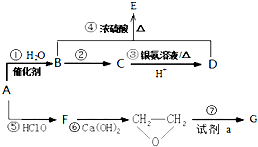 有机物A是石油裂解的主要产物之一,其标准状况下的密度为1.25g/L.反应⑦能缓解目前一个重要的环境问题,生成的聚合物G(C3H4O3)n是一种可降解塑料.有关转化关系如图所示:
有机物A是石油裂解的主要产物之一,其标准状况下的密度为1.25g/L.反应⑦能缓解目前一个重要的环境问题,生成的聚合物G(C3H4O3)n是一种可降解塑料.有关转化关系如图所示: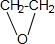 +CaCl2+2H2O.
+CaCl2+2H2O.