题目内容
【题目】合理的利用吸收工业产生的废气CO2可以减少污染,变废为宝。
(1)用CO2可以生产燃料甲醇。
①写出甲醇的官能团名称____________。
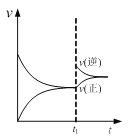
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(l) △H=-49.0kJmol-1;一定条件下,向体积固定为1 L的密闭容器中充入1mol CO2和3mol H2 ,测得CO2和CH3OH(g)的浓度随时间变化曲线如下图所示。
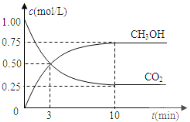
②反应开始至第3分钟时,反应速率v(H2)=________mol/(L·min)。
③该条件下,该反应的平衡常数表达式为________,CO2的平衡转化率是________;
(2)用CO2合成二甲醚(CH3OCH3)。
①CO2 催化加氢合成二甲醚的过程中主要发生下列反应:
反应I:CO2(g) + H2(g)CO(g) + H2O(g) H= +41.2 kJmol-1
反应II: 2CO2(g) + 6H2(g)CH3OCH3(g) + 3H2O(g) H = - 122.5 kJmol-1
其中,反应II 分以下a、b两步完成,请写出反应a的热化学方程式。
a._________
b.2CH3OH(g)CH3OCH3(g) + H2O(g) H = -23.5 kJmol-1
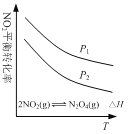
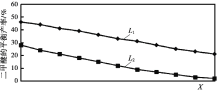
②L(L1、L2)、X分别代表压强或温度,下图表示L一定时,反应II中二甲醚的平衡产率随X变化的关系,其中X代表的物理量是______。判断L1、L2的大小,并简述理由:________。
(3) 恒压时,在CO2和H2起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性(CH3OCH3的选择性=![]() )随温度变化如下图。
)随温度变化如下图。
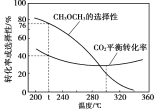
①t℃时,起始投入a molCO2,b mol H2,达到平衡时反应II消耗的H2的物质的量为______mol。
②温度高于300℃,CO2平衡转化率随温度升高而增大的原因是_________。
【答案】羟基 0.5 ![]() 75% CO2(g) + 3H2 (g)CH3OH(g) + H2O(g) H = - 49.5 kJmol-1 温度 L1>L2。反应II是气体化学计量数减少的反应,当温度一定时,增大压强,平衡正向移动,二甲醚平衡产率增大 3a×40%×76% 反应I的H>0,反应II的H<0 ,温度升高使CO2转化为CO的平衡转化率上升,使CO2转化为CH3OCH3的平衡转化率下降,且上升幅度超过下降幅
75% CO2(g) + 3H2 (g)CH3OH(g) + H2O(g) H = - 49.5 kJmol-1 温度 L1>L2。反应II是气体化学计量数减少的反应,当温度一定时,增大压强,平衡正向移动,二甲醚平衡产率增大 3a×40%×76% 反应I的H>0,反应II的H<0 ,温度升高使CO2转化为CO的平衡转化率上升,使CO2转化为CH3OCH3的平衡转化率下降,且上升幅度超过下降幅
【解析】
(1)①甲醇的结构简式是CH3OH;
②根据υ=![]() 计算
计算
③转化率=![]() ;
;
(2) ①根据盖斯定律计算反应a的热化学方程式;
②2CO2(g) + 6H2(g)CH3OCH3(g) + 3H2O(g)正反应放热,升高温度,平衡逆向移动;2CO2(g) + 6H2(g)CH3OCH3(g) + 3H2O(g)正反应气体系数和减小,增大压强,平衡正向移动;
(3) ①根据CH3OCH3的选择性=![]() 计算反应II消耗的H2的物质的量;
计算反应II消耗的H2的物质的量;
②反应I的H>0,温度升高使CO2转化为CO的平衡转化率上升;
(1)①甲醇的结构简式是CH3OH,甲醇含有官能团的名称是羟基;
②根据图象,反应开始至第3分钟时,CO2浓度变化量是0.5mol/L,则氢气浓度变化量是1.5mol/L,υ=![]() 0.5 mol/(L·min);
0.5 mol/(L·min);
③该条件下,CO2(g)+3H2(g)CH3OH(g)+H2O(l)反应的平衡常数表达式为![]() ,CO2的平衡转化率=
,CO2的平衡转化率=![]() 75%;
75%;
(2) ①反应II: 2CO2(g) + 6H2(g)CH3OCH3(g) + 3H2O(g) H = - 122.5 kJmol-1;
根据盖斯定律(II-b)×![]() 得CO2(g) + 3H2 (g)CH3OH(g) + H2O(g) H= - 49.5 kJmol-1;
得CO2(g) + 3H2 (g)CH3OH(g) + H2O(g) H= - 49.5 kJmol-1;
②2CO2(g) + 6H2(g)CH3OCH3(g) + 3H2O(g)正反应放热,升高温度,平衡逆向移动;2CO2(g) + 6H2(g)CH3OCH3(g) + 3H2O(g)正反应气体系数和减小,增大压强,平衡正向移动;由图象可知,随X的增大,CH3OCH3的产率减小,说明平衡逆向移动,所以X表示温度;则L1、L2分别代表不同压强下CH3OCH3的产率,反应II是气体化学计量数减少的反应,当温度一定时,增大压强,平衡正向移动,二甲醚平衡产率增大,则L1>L2;
(3) CH3OCH3的选择性=![]() ,t℃时,CH3OCH3的选择性是76%,CO2的平衡转化率为40%,则
,t℃时,CH3OCH3的选择性是76%,CO2的平衡转化率为40%,则![]() =76%,CH3OCH3的物质的量是
=76%,CH3OCH3的物质的量是![]() mol,反应II消耗的H2的物质的量是
mol,反应II消耗的H2的物质的量是![]() =3a×40%×76%;
=3a×40%×76%;
②反应I的H>0,反应II的H<0 ,温度升高使CO2转化为CO的平衡转化率上升,使CO2转化为CH3OCH3的平衡转化率下降,且上升幅度超过下降幅,所以温度高于300℃,CO2平衡转化率随温度升高而增大。

 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案【题目】某同学在实验室研究锌与酸的反应,实验数据如下:
实验序号 | 锌质量 | 锌状态 | c(H2SO4) | V(H2SO4) | 金属消失时间 |
1 | 0.10 g | 颗粒 | 0.5mol·L-1 | 50mL | 500s |
2 | 0.10 g | 粉末 | 0.5mol·L-1 | 50mL | 50s |
3 | a g | 颗粒 | 1.0mol·L-1 | 50mL | 125s |
分析上述数据,回答下列问题
(1)实验1和2表明,_____对反应速率有影响。
(2)实验1和3研究的是反应物浓度对反应速率的影响,则a =________ g。
(3)该同学研究发现:相同的锌粒分别与H2SO4、盐酸反应(操作如下图),现象差异明显(稀盐酸中锌表面产生气泡的速率要比稀硫酸快)。

该同学对产生这一现象的原因,提出两种假设:
a. 氯离子对反应起促进作用,加快了反应的进行;
b. ________,减缓了反应的进行。
为进一步证实自己的猜想,该同学在室温下,分别取5mL 0.2 mol·L-1盐酸溶液,一份加入一定量的固体___________ (填“所加试剂化学式”),另一份作对比实验,再分别同时加入完全相同的锌粒,比较反应速率的大小。
(4)锌粒和稀硫酸反应制取氢气时,往往加入少量CuSO4粉末,可加快产生H2的速率,其原因是___ (结合化学方程式作出合理解释)。