题目内容
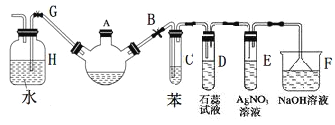
【题目】某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。
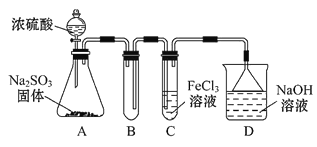
(1)通入足量SO2时C中观察到的现象为_____________________________。
(2)根据以上现象,该小组同学认为SO2与FeCl3溶液发生氧化还原反应。该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42。该做法_______(填“合理”或“不合理”),理由是____________。
(3)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有________(填字母)。
A.浓硫酸 B.酸性KMnO4溶液 C.碘水 D.NaCl溶液
【答案】溶液由棕黄色变成浅绿色 不合理 HNO3可以将SO2氧化成H2SO4,干扰实验 BC
【解析】
装置A中的分液漏斗中的浓硫酸滴入锥形瓶中反应生成二氧化硫气体,通过装置B为安全瓶,通过装置C中的氯化铁溶液具有氧化性能氧化二氧化硫为硫酸,氯化铁被还原为氯化亚铁,最后过量的二氧化硫被氢氧化钠溶液吸收,据此分析解答。
(1)利用Fe3+具有强氧化性,C中发生离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42+4H+,Fe3+显棕黄色,Fe2+显浅绿色,现象为溶液由棕黄色变成浅绿色;
(2)HNO3具有强氧化性,能把SO2氧化成H2SO4,干扰实验,因此该做法不合理;
(3)A、浓硫酸与SO2不发生反应,浓硫酸不能代替FeCl3,故A不符合题意;B、酸性高锰酸钾溶液具有强氧化性,如果紫红色褪去,说明SO2具有还原性,故B符合题意;C、碘水中I2,具有氧化性,能把SO2氧化,淡黄色褪去,说明SO2具有还原性,故C符合题意;D、NaCl溶液不与SO2发生反应,不能鉴别SO2有还原性,故D不符合题意。答案选BC。

 阅读快车系列答案
阅读快车系列答案