题目内容
2.苯是重要的化工原料,以下是某酮酸E的合成路线.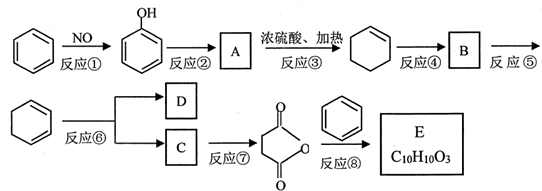
已知:①CH2CH=CHCH3能被氧化成乙酸:
②
 +(CH3CO)2O→
+(CH3CO)2O→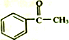 +CH3COOH
+CH3COOH(1)以上合成路线中,属于氧化反应的有:反应⑥和反应①(填反应编号);反应⑤的反应条件是氢氧化钠醇溶液、加热.
(2)写出结构简式A
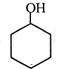 ;B
;B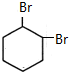 .
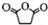
.(3)已知C的分子式为C4H6O4,则D的结构简式为HOOCCOOH;分离C和D的方法是蒸馏.
(4)不能由
 直接制取
直接制取 ,原因是苯中的碳碳键是一种特殊的键,与氢气加成后只能得环已烷.
,原因是苯中的碳碳键是一种特殊的键,与氢气加成后只能得环已烷.(5)写出反应⑧的化学方程式
 +
+ $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$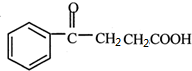 .
.
分析 根据各物质转化关系, 发生氧化反应得
发生氧化反应得 ,
, 与氢气发生加成反应得A为
与氢气发生加成反应得A为 ,A在浓硫酸作用下发生消去反应得
,A在浓硫酸作用下发生消去反应得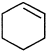 ,
, 与溴加成得B为
与溴加成得B为 ,B发和消去反应得
,B发和消去反应得 ,
, 发生信息①的氧化反应得HOOCCOOH和HOOCCH2CH2COOH,C的分子式为C4H6O4,C发生脱水反应生成
发生信息①的氧化反应得HOOCCOOH和HOOCCH2CH2COOH,C的分子式为C4H6O4,C发生脱水反应生成 ,所以C为HOOCCH2CH2COOH,D为HOOCCOOH,丁二酸酐发生信息②中的取代反应生成E为
,所以C为HOOCCH2CH2COOH,D为HOOCCOOH,丁二酸酐发生信息②中的取代反应生成E为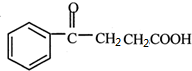 ,据此答题.
,据此答题.
解答 解:根据各物质转化关系, 发生氧化反应得
发生氧化反应得 ,
, 与氢气发生加成反应得A为
与氢气发生加成反应得A为 ,A在浓硫酸作用下发生消去反应得
,A在浓硫酸作用下发生消去反应得 ,
, 与溴加成得B为
与溴加成得B为 ,B发和消去反应得
,B发和消去反应得 ,
, 发生信息①的氧化反应得HOOCCOOH和HOOCCH2CH2COOH,C的分子式为C4H6O4,C发生脱水反应生成
发生信息①的氧化反应得HOOCCOOH和HOOCCH2CH2COOH,C的分子式为C4H6O4,C发生脱水反应生成 ,所以C为HOOCCH2CH2COOH,D为HOOCCOOH,丁二酸酐发生信息②中的取代反应生成E为
,所以C为HOOCCH2CH2COOH,D为HOOCCOOH,丁二酸酐发生信息②中的取代反应生成E为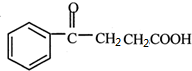 ,
,
(1)根据上面的分析可知,以上合成路线中,属于氧化反应的有:反应⑥和反应①,反应⑤为卤代烃的消去反应,所以反应条件是氢氧化钠醇溶液、加热,
故答案为:①;氢氧化钠醇溶液、加热;
(2)根据上面的分析可知,A为 ,B为
,B为 ,
,
故答案为: ;
; ;
;
(3)根据上面的分析可知,D为HOOCCOOH,C和D都是二元羧酸,它们能互溶但沸点不同,所以分离C和D的方法是蒸馏,
故答案为:HOOCCOOH;蒸馏;
(4)由于苯中的碳碳键是一种特殊的键,与氢气加成后只能得环已烷,所以不能由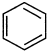 直接制取
直接制取 ,
,
故答案为:苯中的碳碳键是一种特殊的键,与氢气加成后只能得环已烷;
(5)反应⑧的化学方程式为 +
+ $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$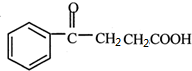 ,
,
故答案为: +
+ $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$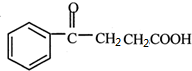 .
.
点评 本题考查有机物推断,注意运用正向推断、逆向推断及题给信息相结合进行分析解答,难度中等.

练习册系列答案
 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
1.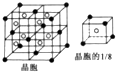 已知A、B、C、D、E、F是周期表中前四周期的六种元素,它们的性质或结构信息如表,请根据信息回答下列问题:
已知A、B、C、D、E、F是周期表中前四周期的六种元素,它们的性质或结构信息如表,请根据信息回答下列问题:
(1)A原子的最外层电子排布式为3s23p4,D原子共有14种不同运动状态的电子,F的离子的价层电子轨道示意图为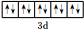 .
.
(2)C与D元素第一电离能的大小关系:Si>Al(填元素符号);
(3)A、B两元素的氢化的分子中键能较小的是H2S(填分子式,下同),分子较稳定的是HCl;
(4)C的单质、镁、NaOH溶液可以构成原电池,则负极的电极反应式为Al-3e-+4OH-=AlO2-+2H2O;
(5)A的氢化物分子中的中心原子的杂化方式为sp3,F的离子可与氨分子形成[F(NH3)4]2+,该阳离子中存在的化学键类型有共价键和配位键;
(6)E与钙可组成离子化合物,其晶细胞结构如图所示,该化合物的电子式为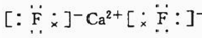 .已知该化合物晶胞$\frac{1}{8}$的体积为2.0×10-23cm3,该离子化合物的密度为3.2g/cm3(保留一位小数).
.已知该化合物晶胞$\frac{1}{8}$的体积为2.0×10-23cm3,该离子化合物的密度为3.2g/cm3(保留一位小数).
 已知A、B、C、D、E、F是周期表中前四周期的六种元素,它们的性质或结构信息如表,请根据信息回答下列问题:
已知A、B、C、D、E、F是周期表中前四周期的六种元素,它们的性质或结构信息如表,请根据信息回答下列问题:| 元素 | 性质或结构信息 |
| A | 单质为黄色粉末,难溶于水,能形成2种二元含氧酸 |
| B | M层有1个未成对的p电子,核外电子总数大于7 |
| C | 与锂形成的合金常用于航天飞行器,单质能溶于强酸和强碱 |
| D | S电子总数比p电子总数少2个,单质或氧化物均具有很高的熔、沸点 |
| E | 周期表中电负性最大的元素 |
| F | 最外层有2个电子,但次外层有18个电子 |
 .
.(2)C与D元素第一电离能的大小关系:Si>Al(填元素符号);
(3)A、B两元素的氢化的分子中键能较小的是H2S(填分子式,下同),分子较稳定的是HCl;
(4)C的单质、镁、NaOH溶液可以构成原电池,则负极的电极反应式为Al-3e-+4OH-=AlO2-+2H2O;
(5)A的氢化物分子中的中心原子的杂化方式为sp3,F的离子可与氨分子形成[F(NH3)4]2+,该阳离子中存在的化学键类型有共价键和配位键;
(6)E与钙可组成离子化合物,其晶细胞结构如图所示,该化合物的电子式为
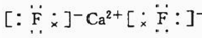 .已知该化合物晶胞$\frac{1}{8}$的体积为2.0×10-23cm3,该离子化合物的密度为3.2g/cm3(保留一位小数).
.已知该化合物晶胞$\frac{1}{8}$的体积为2.0×10-23cm3,该离子化合物的密度为3.2g/cm3(保留一位小数).
2.下列用离子方程式解释正确的是( )
| A. | 用氢氟酸在玻璃上镌刻图案:4I++SiO2═H2O+Si4+ | |
| B. | 向Cu2+、Fe3+混合液中加入CuO除去Fe3+;3H2O+3CuO+2Fe3+═2Fe(OH)3+3Cu2+ | |
| C. | 亚硫酸氢钠溶液显酸性:HSO3-═H++SO32- | |
| D. | 用盐酸与碳酸钠反应证明氯的非金属性强与炭:2H++CO32-═CO2↑+H2O |
19. 氮、磷、砷是原子序数依次增大的第VA族元素,它们的化合物有着独特的性质和重要用途.
氮、磷、砷是原子序数依次增大的第VA族元素,它们的化合物有着独特的性质和重要用途.
(1)基态砷原子的核外电子排布式为[Ar]3d104s24p3.氮、磷、砷的第一电离能顺序为N>P>As(填元素符号).
(2)已知N2O为直线形结构,结构式为N=N=O.则N2O是极性(填“极性”或“非极性”)分子.中间的氮原子杂化轨道类型为sp杂化.
(3)已知下列数据:
NH3的熔、沸点均高于PH3的原因是氨分子之间能形成氢键;PH3的分解温度高于其沸点,其原因是PH3分解需要破坏P-H键,PH3气化需要破坏分子间作用力,而化学键比分子间作用力强得多.
(4)根据价层电子对互斥理论,氨分子中的键角<(填“>”“<”或“=”)109°28°;PO43-离子的空间构型为正四面体.
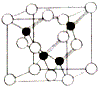
(5)磷化铝的结构与金刚石相似,其结构单元如图所示:经过计算,该晶体的化学式是AlP.
 氮、磷、砷是原子序数依次增大的第VA族元素,它们的化合物有着独特的性质和重要用途.
氮、磷、砷是原子序数依次增大的第VA族元素,它们的化合物有着独特的性质和重要用途.(1)基态砷原子的核外电子排布式为[Ar]3d104s24p3.氮、磷、砷的第一电离能顺序为N>P>As(填元素符号).
(2)已知N2O为直线形结构,结构式为N=N=O.则N2O是极性(填“极性”或“非极性”)分子.中间的氮原子杂化轨道类型为sp杂化.
(3)已知下列数据:
| 物质 | 熔点/℃ | 沸点/℃ | 分解温度/℃ |
| NH3 | 195.3 | 239.7 | 107.3 |
| PH3 | 139.2 | 185.4 | 713.2 |
(4)根据价层电子对互斥理论,氨分子中的键角<(填“>”“<”或“=”)109°28°;PO43-离子的空间构型为正四面体.
(5)磷化铝的结构与金刚石相似,其结构单元如图所示:经过计算,该晶体的化学式是AlP.
6.有关下列两种溶液的说法中,不正确的是( )
①0.2mo1•L-1 CH3COONa溶液 ②0.1mo1•L-1H2SO4溶液.
①0.2mo1•L-1 CH3COONa溶液 ②0.1mo1•L-1H2SO4溶液.
| A. | 相同温度下,溶液中水的电离程度:①>② | |
| B. | 向①加水后所得溶液c(CH3COO-)/c(CH3COOH)的比值变大 | |
| C. | 等体积混合溶液①和溶液②,所得溶液中2c(SO42-)=c(Na+) | |
| D. | 25℃时,向溶液②中滴加溶液①至pH=7,溶液中c(Na+)>c(CH3COO-)+c(SO42-) |
7.共价键、离子键、分子间作用力都是粒子间的作用力,含有以上两种作用力的晶体是( )
| A. | SiO2 | B. | CO2 | C. | NaCl | D. | Ar |
14.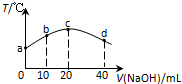 若往20mL 0.01mol•L-l HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )
若往20mL 0.01mol•L-l HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )
 若往20mL 0.01mol•L-l HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )
若往20mL 0.01mol•L-l HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )| A. | HNO2的电离平衡常数:c点>b点 | |
| B. | b点混合溶液显酸性:c(Na+)>c(NO2-)>c(H+)>c(OH-) | |
| C. | c点混合溶液中:c(OH-)>c(HNO2) | |
| D. | d点混合溶液中:c(Na+)>c(OH-)>c(NO2-)>c(H+) |
12.下列表达方式错误的是( )
| A. | 氢有三种核素:H、D、T | B. | S2-的结构示意图: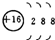 | ||
| C. | 石英中存在SiO2分子 | D. | CO2分子的结构式:O=C=O |
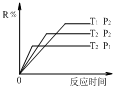 在某密闭容器中进行 以下反应:M(g)+N(g)?R(g)+2L(?),且此反应符合如图所示图象.图中R%表示R在平衡混合物中的含量,T1、T2表示体系温度,P1、P2表示体系压强.请判断
在某密闭容器中进行 以下反应:M(g)+N(g)?R(g)+2L(?),且此反应符合如图所示图象.图中R%表示R在平衡混合物中的含量,T1、T2表示体系温度,P1、P2表示体系压强.请判断