题目内容
(10分)
(1)将NaOH溶液滴入FeSO4溶液中,能观察到的现象是 。
(2)向10mL lmol/L的NaOH溶液中加入10mL l mol/L的H2SO4溶液,加热、蒸干,得到固体A的化学式是 。
(3)向40mL 1mol/L的NaOH溶液中通入过量的CO2,并将溶液分成两等份。
①一份加热、蒸干、灼烧,所得固体的化学式是 。
②将(2)中所得固体A全部放入另一份溶液中,发生反应的离子方程式是 。混合后的溶液充分搅拌后,加热、蒸干、灼烧,所得固体中两种阴离子的物质的量之比是 。
(1)将NaOH溶液滴入FeSO4溶液中,能观察到的现象是 。
(2)向10mL lmol/L的NaOH溶液中加入10mL l mol/L的H2SO4溶液,加热、蒸干,得到固体A的化学式是 。
(3)向40mL 1mol/L的NaOH溶液中通入过量的CO2,并将溶液分成两等份。
①一份加热、蒸干、灼烧,所得固体的化学式是 。
②将(2)中所得固体A全部放入另一份溶液中,发生反应的离子方程式是 。混合后的溶液充分搅拌后,加热、蒸干、灼烧,所得固体中两种阴离子的物质的量之比是 。
(1)先产生白色沉淀,并逐渐变成灰绿色,最后变成红褐色。
(2)NaHSO4
(3)向40mL 1mol/L的NaOH溶液中通入过量的CO2,并将溶液分成两等份。
①Na2CO3
②HCO3-+H+=H2O+CO2↑
n(SO42-):n(CO32-)=2:1
(2)NaHSO4
(3)向40mL 1mol/L的NaOH溶液中通入过量的CO2,并将溶液分成两等份。
①Na2CO3
②HCO3-+H+=H2O+CO2↑
n(SO42-):n(CO32-)=2:1
(1)先产生白色沉淀,并逐渐变成灰绿色,最后变成红褐色。
Fe2++2OH―="Fe" (OH)2↓白色变成灰绿色
4Fe (OH)2+O2+2H2O="4Fe" (OH)3最后变成红褐色;
(2)NaOH :10mL× lmol/L="10mmol," H2SO4:10mL× lmol/L=10mmol
NaOH+H2SO4=NaHSO4+H2O
A的化学式NaHSO4
(3)向40mL 1mol/L的NaOH溶液中通入过量的CO2,NaOH+CO2=NaHCO3,每份NaHCO3为20mmol,
①一份加热、蒸干、灼烧,2NaHCO3
 Na2CO3+H2O+CO2↑所得固体的化学式是Na2CO3
Na2CO3+H2O+CO2↑所得固体的化学式是Na2CO3②将(2)中所得固体A全部放入另一份溶液中,发生反应的离子方程式是HCO3-+H+=H2O+CO2↑;与H+反应掉的NaHCO3为10mmol,余下10mmolNaHCO3,加热分解后留下5mmolNa2CO3
n(SO42-)="10mL×" lmol/L="10mmol," n(CO32-)="5mmol," n(SO42-):n(CO32-)=2 ;1

练习册系列答案
相关题目
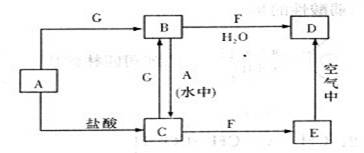
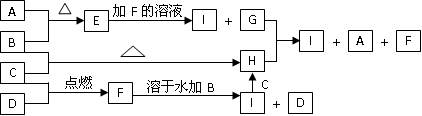
 (4)写出G+H I+A+F的离子方程式_______________________________。
(4)写出G+H I+A+F的离子方程式_______________________________。