题目内容
2.下列分子的中心原子形成sp2杂化轨道的是( )| A. | H2O | B. | NH3 | C. | C2H4 | D. | CH4 |
分析 根据价层电子对互斥理论确定原子杂化方式,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$×(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数,据此判断杂质类型;
解答 解:A.H2O中O原子的价层电子对个数=2+$\frac{1}{2}$(6-2×1)=4,所以O原子采用sp3杂化,故A错误;
B.NH3中N原子价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$×(5-3×1)=4,中心原子是以sp3杂化,故B错误;
C.C2H4中C原子含有3个σ键,价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$×(4-4×1)=3,不含孤电子对,为sp2杂化,故C正确;
D.CH4中C原子杂化轨道数=δ键数+孤对电子对数=4+0=4,所以采取sp3杂化,故D错误;
故选C.
点评 本题考查了原子杂化类型的判断,难度不大,根据“价层电子对个数=σ键个数+孤电子对个数”来解答即可,原子杂化类型的判断是高考的热点,所以是学习的重点.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
12.下列物质的电子式书写正确的是( )
| A. | CH3OH 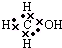 | B. | HClO 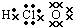 | C. | N2 | D. | OH- |
13.冰融化为水的过程的焓变和熵变正确的是( )
| A. | △H>0,△S<0 | B. | △H<0,△S>0 | C. | △H>0,△S>0 | D. | △H<0,△S<0 |
10.用如图所示方法,检验某固体中是否含有Cl-,下列说法正确的是( )

| A. | ①是BaCl2溶液,②稀盐酸 | B. | ①是稀盐酸,②稀BaCl2溶液 | ||
| C. | ①是稀硝酸,②是AgNO3溶液 | D. | ①是稀硫酸,②是AgNO3溶液 |
7.下列关系正确的是( )
| A. | 熔点:庚烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷 | |
| B. | 含氢量:甲烷>乙烯>乙炔>苯 | |
| C. | 密度:CCl4>CHCl3>苯>H2O | |
| D. | 同物质的量物质燃烧耗O2量:已烷>环已烷>苯>苯甲酸 |
14.下列说法正确的是( )
| A. | 丙烯分子中有7个σ键,2个π键 | |
| B. | 在60 g SiO2晶体中,Si-O键的数目为2NA | |
| C. | 共价键有方向性,但无饱和性 | |
| D. | 由ⅠA族和ⅥA族元素形成的原子个数比为1:1、电子总数为38的化合物,是含有共价键的离子化合物 |
11.下列各项正确的是( )
| 电极反应式 | 出现环境 | |
| A | O2+2H2O+4e-═4OH- | 碱性环境下氢氧燃料电池的负极反应 |
| B | 4OH--4e-═2H2O+O2↑ | 弱酸性环境下钢铁的吸氧腐蚀 |
| C | 2H++2e-═H2↑ | 用惰性电极电解NaOH溶液的阴极反应 |
| D | H2-2e-═2H+ | 用惰性电极电解H2SO4的阳极反应 |
| A. | A | B. | B | C. | C | D. | D |
12.现有部分短周期元素的性质或原子结构如下表:
(1)元素T的原子最外层共有6种不同运动状态的电子.元素X的一种同位素可测定文物年代,这种同位素的符号是14C.
(2)元素Y与氢元素形成一种离子YH${\;}_{4}^{+}$,写出该微粒的电子式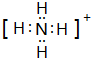 (用元素符号表示).
(用元素符号表示).
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是bef.
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
d.Z原子的价电子数比T原子多
e.Z的最高价氧化物的水化物酸性强于T的最高价氧化物的水化物.
f.Z的单质能与T的氢化物水溶液发生置换反应
(4)Z有多种常见含氧酸,酸性由强到弱的顺序是HClO4>HClO3>HClO.
| 元素编号 | 元素性质或原子结构 |
| T | M层上有2对成对电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(2)元素Y与氢元素形成一种离子YH${\;}_{4}^{+}$,写出该微粒的电子式
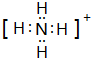 (用元素符号表示).
(用元素符号表示).(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是bef.
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
d.Z原子的价电子数比T原子多
e.Z的最高价氧化物的水化物酸性强于T的最高价氧化物的水化物.
f.Z的单质能与T的氢化物水溶液发生置换反应
(4)Z有多种常见含氧酸,酸性由强到弱的顺序是HClO4>HClO3>HClO.

