题目内容
【题目】根据价层电子对互斥理论及原子的杂化轨道理论判断NF3分子的空间构型和中心原子的杂化方式为( )
A. 直线形 sp杂化 B. 三角形 sp2杂化
C. 三角锥型 sp2杂化 D. 三角锥型 sp3杂化
【答案】D
【解析】试题分析:根据价层电子对互斥理论可知,NF3分子中氮原子含有的孤对电子对数=(5-3×1)÷2=1,所以NF3是三角锥形结构,氮原子是sp3杂化,答案选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】(1)已知甲烷的燃烧热是890 kJ/mol,且1 mol H2O由气态变为液态时放出44 kJ的能量。请写出甲烷燃烧生成水蒸气的热化学反应方程式为:____________________________;
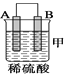
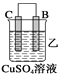
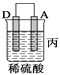
(2)由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
①装置甲中作正极的是__________________ (填“A”或“B”) ;
②装置乙溶液中C电极反应:__________________________________;
③装置丙中金属A上电极反应属于______________(填“氧化反应”或“还原反应”);
④四种金属活动性由强到弱的顺序是___________________________。