题目内容
【题目】(1)已知甲烷的燃烧热是890 kJ/mol,且1 mol H2O由气态变为液态时放出44 kJ的能量。请写出甲烷燃烧生成水蒸气的热化学反应方程式为:____________________________;
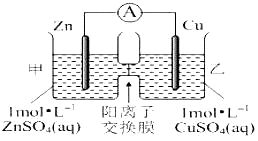
(2)由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
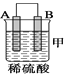
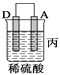
①装置甲中作正极的是__________________ (填“A”或“B”) ;
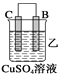
②装置乙溶液中C电极反应:__________________________________;
③装置丙中金属A上电极反应属于______________(填“氧化反应”或“还原反应”);
④四种金属活动性由强到弱的顺序是___________________________。
【答案】 CH4(g)+2O2(g)==CO2(g)+2H2O(g) ΔH=-802 KJ/mol B Cu2++2e-==Cu 还原反应 D>A>B>C
【解析】(1)燃烧热是指在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量。根据题意可知,1mol甲烷完全燃烧生成2mol液态水,放出的热量是890kJ。而2mol液态水变成气态水又吸收44kJ×4=176kJ,所以甲烷燃烧生成水蒸气的反应热是(890+176)kJ/mol=802kJ/mol,因此热化学方程式为:CH4(g)+2O2(g)==CO2(g)+2H2O(g) ΔH=-802 kJ/mol;(2)①该装置中,金属A不断溶解说明A失电子发生氧化反应生成金属阳离子进入溶液而作负极,则作正极的是B,答案选B;②乙装置中,C的质量增加说明C电极上铜离子得电子发生还原反应,则C作正极,电极反应式为Cu2++2e-═Cu;③丙装置中A上有气体产生,说明A上氢离子得电子发生还原反应而作正极,正极上氢离子得电子发生还原反应;④通过以上分析知,四种金属活动性强弱顺序是D>A>B>C。

【题目】Ⅰ.溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按以下步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL 液态溴。向a中滴入几滴溴,a中液体立即沸腾,并有红棕色蒸气出现;a中发生的化学方程式为;继续滴加至液溴滴完。仪器a的名称是装置d中的作用是。仪器c为冷凝管,其进水口为(填“上”或“下”)口。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是。
(3)经过上述分离操作后,粗溴苯中还含有的主要杂质为 , 要进一步提纯,下列操作中必须的是。
A.重结晶 B.过滤 C.蒸馏 D.萃取