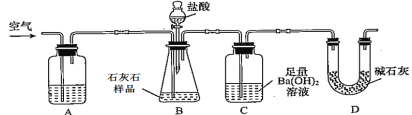
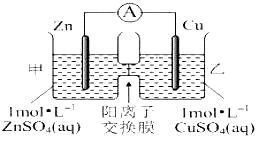
题目内容
【题目】在0.1mol/LCH3COOH溶液中存在如下电离平衡:CH3COOH ![]() CH3COO-+H+对于该平衡,下列叙述正确的是( )
CH3COO-+H+对于该平衡,下列叙述正确的是( )
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1mol·L-1 HCl溶液,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向正反应方向移动
【答案】B
【解析】A项加入水时,平衡正反应方向移动,A不符合题意;
B项加入少量的NaOH固体,则会消耗溶液中的H+,平衡向正反应方向移动,B符合题意;
C项,、加入少量0.1 mol/L HCl溶液,平衡虽然会向逆反应方向移动,但溶液中C(H+)增大,C不符合题意;
D项加入少量CH3COONa 固体,溶液中的CH3COO—的浓度增大,平衡向逆反应方向移动,D不符合题意。
所以答案是:B
【考点精析】根据题目的已知条件,利用弱电解质在水溶液中的电离平衡的相关知识可以得到问题的答案,需要掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.

【题目】Ⅰ.溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按以下步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL 液态溴。向a中滴入几滴溴,a中液体立即沸腾,并有红棕色蒸气出现;a中发生的化学方程式为;继续滴加至液溴滴完。仪器a的名称是装置d中的作用是。仪器c为冷凝管,其进水口为(填“上”或“下”)口。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是。
(3)经过上述分离操作后,粗溴苯中还含有的主要杂质为 , 要进一步提纯,下列操作中必须的是。
A.重结晶 B.过滤 C.蒸馏 D.萃取
【题目】工业酸性废水中的Cr2O72-可转化为Cr3+除去,实验室用电解法模拟该过程,结果如下表所示(实验开始时溶液体积为50mL,Cr2O72-的起始浓度、电压、电解时间均相同)。下列说法中,不正确的是
实验 | ① | ② | ③ |
电解条件 | 阴、阳极均为石墨 | 阴、阳极均为石墨, 滴加1mL浓硫酸 | 阴极为石墨,阳极为铁,滴加1mL浓硫酸 |
Cr2O72-的去除率/% | 0.922 | 12.7 | 57.3 |
A. 对比实验①②可知,降低pH可以提高Cr2O72-的去除率
B. 实验②中,Cr2O72-在阴极放电的电极反应式是Cr2O72-+6e-+14H+═2Cr3++7H2O
C. 实验③中,Cr2O72-去除率提高的原因是Cr2O72-+6 Fe2++14H+═2Cr3++6Fe3++7H2O
D. 实验③中,理论上电路中每通过6mol电子,则有1molCr2O72-被还原