题目内容
【题目】燃煤烟气的脱硫脱硝是目前研究的热点。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) △H= -574 kJmol-1
②CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) △H= -1160 kJmol-1
③H2O(g) = H2O(l) △H= -44 kJmol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O( l ) 的热化学方程式_____________。
(2)某科研小组研究臭氧氧化--碱吸收法同时脱除SO2和NO工艺,氧化过程反应原理及反应热、活化能数据如下:
反应Ⅰ:NO(g)+ O3(g) ![]() NO2(g)+O2(g) △H1 = -200.9 kJmol-1 Ea1 = 3.2 kJmol-1
NO2(g)+O2(g) △H1 = -200.9 kJmol-1 Ea1 = 3.2 kJmol-1
反应Ⅱ:SO2(g)+ O3(g)![]() SO3(g)+O2(g) △H2 = -241.6 kJmol-1 Ea2 = 58 kJmol-1
SO3(g)+O2(g) △H2 = -241.6 kJmol-1 Ea2 = 58 kJmol-1
已知该体系中臭氧发生分解反应:2O3(g) ![]() 3O2(g)。请回答:
3O2(g)。请回答:
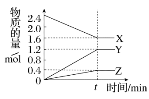
其它条件不变,每次向容积为2L的反应器中充入含1.0 mol NO、1.0 mol SO2的模拟烟气和2.0 mol O3,改变温度,反应相同时间t后体系中NO和SO2的转化率如图所示:

①由图可知相同温度下NO的转化率远高于SO2,结合题中数据分析其可能原因_______。
②下列说法正确的是________。
A.P点一定为平衡状态点
B.温度高于200℃后,NO和SO2的转化率随温度升高显著下降、最后几乎为零
C.其它条件不变,若缩小反应器的容积可提高NO和SO2的转化率
③假设100℃时P、Q均为平衡点,此时反应时间为10分钟,发生分解反应的臭氧占充入臭氧总量的10%,则体系中剩余O3的物质的量是________mol;NO的平均反应速率为________;反应Ⅱ在此时的平衡常数为_______________。
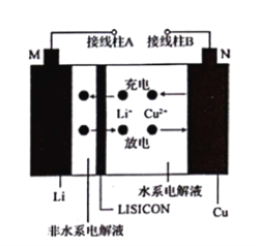
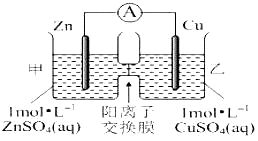
(3)用电化学法模拟工业处理SO2。将硫酸工业尾气中的SO2通入如图装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电能:

①M极发生的电极反应式为___________________。
②当外电路通过0.2 mol电子时,质子交换膜左侧的溶液质量_____(填“增大”或“减小”)____克。
【答案】 CH4(g)+2NO2(g)= N2(g)+CO2(g)+2H2O(l) △H=-955 kJ/mol 反应Ⅰ的活化能小于反应Ⅱ,相同条件下更易发生反应 BC 0.65 0.0425mol/(L·min) 0.96 SO2+2H2O-2e- =SO42- +4H+ 增大 6.2
【解析】(1)①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574 kJmol-1,②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160 kJmol-1,③H2O(g)═H2O(l)△H=-44.0 kJmol-1,根据盖斯定律,将![]() ×(①+②+③×4)得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l) △H=
×(①+②+③×4)得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l) △H=![]() ×[(-574 kJmol-1)+(-1160 kJmol-1)+(-44.0 kJmol-1)×4]=-955kJmol-1,故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l) △H=-955kJmol-1;
×[(-574 kJmol-1)+(-1160 kJmol-1)+(-44.0 kJmol-1)×4]=-955kJmol-1,故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l) △H=-955kJmol-1;
(2)①反应Ⅰ:NO(g)+ O3(g) ![]() NO2(g)+O2(g) △H1 = -200.9 kJmol-1 Ea1 = 3.2 kJmol-1
NO2(g)+O2(g) △H1 = -200.9 kJmol-1 Ea1 = 3.2 kJmol-1
反应Ⅱ:SO2(g)+ O3(g)![]() SO3(g)+O2(g) △H2 = -241.6 kJmol-1 Ea2 = 58 kJmol-1,反应Ⅰ的活化能小于反应Ⅱ,相同条件下更易发生反应,因此相同温度下NO的转化率远高于SO2,故答案为:反应Ⅰ的活化能小于反应Ⅱ,相同条件下更易发生反应;
SO3(g)+O2(g) △H2 = -241.6 kJmol-1 Ea2 = 58 kJmol-1,反应Ⅰ的活化能小于反应Ⅱ,相同条件下更易发生反应,因此相同温度下NO的转化率远高于SO2,故答案为:反应Ⅰ的活化能小于反应Ⅱ,相同条件下更易发生反应;
②A.图中曲线属于描点法所得图像,P点不一定为图像的最高点,即不一定为平衡状态点,可能是建立平衡过程中的一点,故A错误;B.根据图像,温度高于200℃后,2O3(g) ![]() 3O2(g)反应进行程度加大,体系中的臭氧浓度减小,NO和SO2的转化率随温度升高显著下降、当臭氧完全分解,则二者转化率几乎为零,故B正确;C.其它条件不变,若缩小反应器的容积,使得2O3(g)
3O2(g)反应进行程度加大,体系中的臭氧浓度减小,NO和SO2的转化率随温度升高显著下降、当臭氧完全分解,则二者转化率几乎为零,故B正确;C.其它条件不变,若缩小反应器的容积,使得2O3(g) ![]() 3O2(g)平衡逆向移动,臭氧浓度增大,反应Ⅰ:NO(g)+ O3(g)
3O2(g)平衡逆向移动,臭氧浓度增大,反应Ⅰ:NO(g)+ O3(g) ![]() NO2(g)+O2(g) 和反应Ⅱ:SO2(g)+ O3(g)
NO2(g)+O2(g) 和反应Ⅱ:SO2(g)+ O3(g)![]() SO3(g)+O2(g)平衡正向移动, NO和SO2的转化率提高,故C正确;故选BC;
SO3(g)+O2(g)平衡正向移动, NO和SO2的转化率提高,故C正确;故选BC;
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955kJmol-1
③反应Ⅰ:NO(g)+ O3(g) ![]() NO2(g)+O2(g)中NO的转化率为85%,则反应的NO为0.85mol,O3为0.85mol;反应Ⅱ:SO2(g)+ O3(g)
NO2(g)+O2(g)中NO的转化率为85%,则反应的NO为0.85mol,O3为0.85mol;反应Ⅱ:SO2(g)+ O3(g)![]() SO3(g)+O2(g)中SO2的转化率为30%,反应的SO2为0.3mol,O3为0.3mol,2O3(g)
SO3(g)+O2(g)中SO2的转化率为30%,反应的SO2为0.3mol,O3为0.3mol,2O3(g) ![]() 3O2(g)中发生分解反应的臭氧占充入臭氧总量的10%,为0.2mol,则体系中剩余O3的物质的量=2.0mol-0.85mol-0.3mol-0.2mol=0.65mol;NO的平均反应速率=
3O2(g)中发生分解反应的臭氧占充入臭氧总量的10%,为0.2mol,则体系中剩余O3的物质的量=2.0mol-0.85mol-0.3mol-0.2mol=0.65mol;NO的平均反应速率=![]() =0.0425mol/(L·min);平衡是为0.85mol+0.30mol+0.3mol=1.45mol,反应Ⅱ的平衡常数=
=0.0425mol/(L·min);平衡是为0.85mol+0.30mol+0.3mol=1.45mol,反应Ⅱ的平衡常数=![]() =0.96,故答案为:0.65;0.0425mol/(L·min);0.96;
=0.96,故答案为:0.65;0.0425mol/(L·min);0.96;
(3)①本质是二氧化硫、氧气与水反应生成硫酸,M电极为负极,N电极为正极,M电极上二氧化硫失去电子氧化生成SO42-,根据原子守恒会电荷守恒可知,有水参加反应,有氢离子生成,电极反应式为:SO2+2H2O-2e -═SO42-+4H+,故答案为:SO2+2H2O-2e -═SO42-+4H+;
②负极反应式为:SO2+2H2O-2e -═SO42-+4H+,正极反应式为O2 + 4e-- + 4H+ == 2H2O,当外电路通过0.2 mol电子时,负极反应的二氧化硫为0.1mol,质量为6.4g,同时有0.2mol氢离子通过质子交换膜进入右侧,左侧溶液质量增大6.4g-0.2g=6.2g,故答案为:增大;6.2。