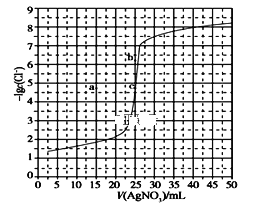
题目内容
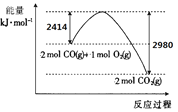
【题目】25 ℃时,向等浓度的NaCl和Na2CrO4溶液中分别滴加AgNO3溶液(已知:Ag2CrO4为砖红色),平衡时溶液中相关离子浓度的关系如图所示。下列说法正确的是( )
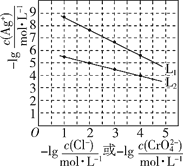
A.L1为向Na2CrO4溶液中滴加AgNO3溶液时的离子浓度关系曲线
B.Ksp(AgCl)的数量级为10-12
C.L1和L2交点处对应的两种溶液中c(Ag+)=c(Cl-)=c(CrO42-)
D.用AgNO3标准溶液测定溶液中Cl-含量时可用Na2CrO4做指示剂
【答案】D
【解析】
A. 25 ℃时,向等浓度的NaCl和Na2CrO4溶液中分别滴加AgNO3溶液,随着Ag+浓度的增大,Cl-和CrO42-离子浓度降低,因为Ag+与Cl-1:1结合,而Ag+与CrO42-2:1结合,所以滴加硝酸银时,对氯化钠溶液中Cl-浓度影响幅度较大,分析图像中曲线的变化趋势知,L1为向NaCl溶液中滴加AgNO3溶液时的离子浓度关系曲线,故A错误;
B. 曲线L1可知,当Cl-浓度为10-4.5mol/L时,Ag+浓度近似为10-5mol/L,所以Ksp(AgCl)的数量级为10-10,故B错误;
C. 由图示L1和L2曲线的变化趋势知, L1和L2交点,c(Ag+)大于10-5mol/L,而c(Cl-)、c(CrO42-)小于10-5mol/L,所以它们不可能相等,故C错误;
D. 由题给信息可知,用硝酸银溶液滴定Cl-时,用Na2CrO4做指示剂,氯化银先沉淀,当溶液中出现砖红色Ag2CrO4时,表面Cl-已被定量沉淀,故D正确。
故选D。

【题目】T、W、X、Y、Z为前四周期元素,其原子序数依次增大,有关五种元素的性质或原子结构描述如下:
元素符号 | 元素性质或原子结构 |
T | 其一种无色氧化物遇空气变为红棕色 |
W | 其单质和化合物的焰色反应焰色均呈黄色 |
X | 基态原子的最外层电子排布式为 |
Y | 单质常温下为气体,可用于自来水消毒 |
Z | 一种核素的质量数为56,中子数为30 |
(1)Z元素位于周期表中第_ ______ 族,其基态原子的价层电子排布式为:______ ;
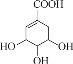
(2)T的一种化合物为![]() ,该分子中极性键和非极性键的数目之比为 ______,T的最低价氢化物与其最高价氧化物的水化物能发生化合反应,其产物属于______ 晶体。
,该分子中极性键和非极性键的数目之比为 ______,T的最低价氢化物与其最高价氧化物的水化物能发生化合反应,其产物属于______ 晶体。
(3)W、X和Y三种元素中,第一电离能最小的为 ______ (填元素符号);W、X和Y的简单离子的半径从小到大的顺序为 ______ (用离子符号表示)。
(4)Z与水蒸气反应的化学方程式为:_____。