题目内容
【题目】下列相关实验的叙述中,正确的是( )
A. HClO、活性炭均能使某些有色物质褪色,说明二者均有氧化性
B. 加热分别盛有NaHCO3和碘的两支试管,试管底部固体均减少,说明二者均发生升华
C. 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来
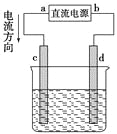
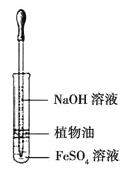
D. 用上图装置观察 Fe(OH)2 的生成
【答案】D
【解析】
A. HClO具有强氧化性能使某些有色物质褪色,活性炭具有吸附性,也能使某些有色物质褪色,A错误;
B. 加热分别盛有NaHCO3和碘的两支试管,碳酸氢钠分解生成碳酸钠、水和二氧化碳,碘升华,因此试管底部固体均减少,B错误;
C. 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,由于生成的氧化铝的熔点高于金属铝的熔点,所以熔化后的液态铝不会滴落下来,C错误;
D. 植物油能够隔绝空气,防止氧气氧化氢氧化亚铁,则可用上图装置观察Fe(OH)2的生成,D正确。
答案选D。

【题目】向2 L密闭容器中加入一定量的固体A和气体B,发生反应A(s)+2B(g) ![]() D(g)+E(g)ΔH=Q kJ·mol-1。在T1 ℃时,反应进行到不同时间测得各物质的物质的量如表:
D(g)+E(g)ΔH=Q kJ·mol-1。在T1 ℃时,反应进行到不同时间测得各物质的物质的量如表:
时间(min) 物质的量(mol) | 0 | 10 | 20 | 30 | 40 | 50 |
B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
(1)T ℃时,该反应的平衡常数K=____________________________。
(2)30 min后,只改变某一条件,反应重新达到平衡,据表中数据判断改变的条件可能是_____(填编号)。
a.通入一定量的B b.加入一定量的固体A c.适当缩小容器的体积
d.升高反应体系温度 e.同时加入0.2 mol B、0.1 mol D、0.1 mol E
(3)对于该反应,用各物质表示的反应速率与时间的关系示意曲线为下图中的____________(填序号)。
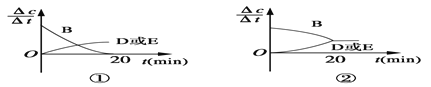

(4)容器的体积和温度T1 ℃不变,向该容器中加入1.60 mol B、0.20 mol D、0.20 mol E和n mol A,达到平衡后,与表格中20分钟时各物质的浓度完全相同,投入固体A的物质的量n的取值范围是______。
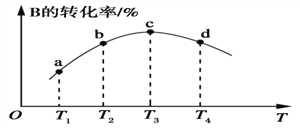
(5)若该密闭容器绝热,实验测得B的转化率随温度变化的示意图如图所示。由图可知,Q________0(填“大于”或“小于”),c点v正________v逆(填“大于”、“小于”或“等于”)。
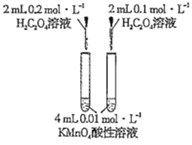
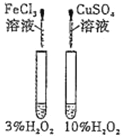
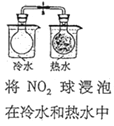
【题目】下列实验方案中不能达到相应实验目的的是
选项 | A | B | C | D |
方案 |
|
|
|
|
目的 | 探究浓度对化学反应速率的影响 | 探究催化剂对H2O2分解速率的影响 | 室温下比较NaHCO3和Na2CO3的溶解度 | 探究温度对化学平衡的影响 |
A. A B. B C. C D. D