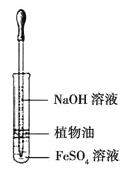
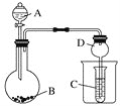
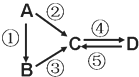
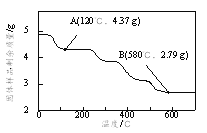
题目内容
【题目】生产环氧乙烷(![]() )的反应为:2CH2=CH2(g)+O2(g)
)的反应为:2CH2=CH2(g)+O2(g)![]() 2
2![]() (g) ΔH=-106kJ/mol,其反应机理如下:
(g) ΔH=-106kJ/mol,其反应机理如下:
①Ag+O2→AgO2 慢
②CH2=CH2+AgO2→![]() + AgO 快
+ AgO 快
③CH2=CH2+6AgO→2CO2+2H2O+6Ag 快
下列有关该反应的说法正确的是
A. 反应的活化能等于106 kJ/mol
B. 该反应的原子利用率为100%
C. AgO2也是该反应的催化剂
D. 增大乙烯的浓度只能显著提高环氧乙烷的生成速率
【答案】B
【解析】A项,反应的ΔH=-106kJ/mol,不能确定反应的活化能;B项,该反应中只有1种生成物,原子利用率为100%;C项,AgO2是中间产物;D项,增大乙烯的浓度可提高环氧乙烷的生成速率,同时提高O2的转化率、环氧乙烷的产量。
A项,反应的ΔH=-106kJ/mol,不能确定反应的活化能,A项错误;B项,该反应中只有1种生成物,原子利用率为100%,B项正确;C项,根据反应的机理,AgO2是中间产物,C项错误;D项,增大乙烯的浓度可提高环氧乙烷的生成速率,增大乙烯的浓度平衡向正反应方向移动,提高O2的转化率、环氧乙烷的产量,D项错误;答案选B。

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案
相关题目