题目内容
【题目】下列实验方案中不能达到相应实验目的的是
选项 | A | B | C | D |
方案 |
|
|
|
|
目的 | 探究浓度对化学反应速率的影响 | 探究催化剂对H2O2分解速率的影响 | 室温下比较NaHCO3和Na2CO3的溶解度 | 探究温度对化学平衡的影响 |
A. A B. B C. C D. D
【答案】B
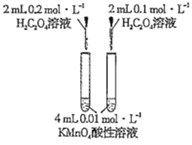
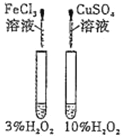
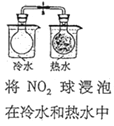
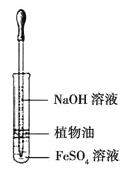
【解析】A项,酸性KMnO4溶液等浓度等体积,H2C2O4溶液等体积不同浓度,探究H2C2O4浓度不同对化学反应速率的影响;B项,催化剂不同,H2O2浓度不同,不能探究催化剂对H2O2分解速率的影响;C项,温度、水、加入的NaHCO3和Na2CO3的质量相同,通过观察不溶固体的多少确定室温下NaHCO3和Na2CO3溶解度的大小;D项,其他条件相同,探究温度对化学平衡的影响。
A项,酸性KMnO4溶液等浓度等体积,H2C2O4溶液等体积不同浓度,通过观察紫红色褪去的快慢,探究H2C2O4浓度不同对化学反应速率的影响,A项能达到目的;B项,催化剂不同,H2O2浓度不同,H2O2分解速率的不同是催化剂不同引起的还是浓度不同引起的无法确定,不能探究催化剂对H2O2分解速率的影响,B项不能达到目的;C项,温度、水、加入的NaHCO3和Na2CO3的质量相同,通过观察不溶固体的多少确定室温下NaHCO3和Na2CO3溶解度的大小,C项能达到目的;D项,其他条件相同,通过观察温度不同颜色深浅的变化探究温度对化学平衡的影响,D项能达到目的;答案选B。

 阅读快车系列答案
阅读快车系列答案【题目】利用含铜、铁的粗锌制备硫酸锌及相关物质。工艺流程图及有关数据如下:

物质 | Cu(OH)2 | Zn(OH)2 | Fe(OH)3 | ZnS | CuS |
Ksp | 5.0×10-20 | 2.0×10-16 | 4.0×10-38 | 1.2×10-23 | 8.5×10-45 |
请回答下列问题:
(1)粗锌中的铜与混酸的稀溶液反应的化学方程式为__________________________,图中处理气体X要能够体现绿色化学思想,还需补充气体______(填化学式)。
(2)若溶液I中c(Cu2+)为0.05mol·L-1,则溶液II中c(Fe3+)>____mol·L-1。
(3)若固体A是Zn,取9.61 g固体C溶解于足量的500mL 2 mol·L-1稀硝酸中,共收集到标准状况下2.24L的气体,向所得溶液中加入2 mol·L-1NaOH溶液,则当生成沉淀最多时,沉淀的质量为_____g;若固体A是另一种物质,取部分固体C于试管中,加入盐酸产生有臭鸡蛋味气体,则该反应的离子方程式为________________________。
(4)溶液Ⅲ经过蒸发浓缩、____________、过滤、洗涤、干燥,即得到较纯净的硫酸锌晶体;溶液还可以制备ZnS,实际选择的是(NH4)2S溶液而不是Na2S溶液作为反应物,理由是后者制得的ZnS含有较多的杂质,则该杂质是____________(填化学式)。
(5)金属锌常用作酸性干电池的负极,干电池不使用时,由于负极与电解质溶液接触而发生自放电反应:2NH4++Zn=2NH3+H2↑+Zn2+,造成电量自动减少。写出铅蓄电池不使用时,其正极上发生自放电的化学方程式__________________________。