题目内容
【题目】某溶液既能溶解Al(OH)3,又能溶解Al,但不能溶解Fe,在该溶液中可以大量共存的离子组是 ( )
A. K+、Na+、HCO3-、NO3- B. Na+、SO42-、Cl-、S2-
C. NH4+、Mg2+、SO42-、NO3- D. H+、K+、Cl-、Na+
【答案】B
【解析】
既能溶解Al(OH)3,又能溶解Al,但不能溶解Fe的溶液是强碱溶液。
A.强碱溶液中不能大量存在HCO3-,A项错误;
B.碱溶液中B组离子之间互不反应,能大量共存,B项正确;
C.碱溶液中不能大量存在NH4+、Mg2+,C项错误;
D.碱溶液中不能大量存在H+,D项错误;
答案选B。

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案【题目】某温度下,反应H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=![]() 。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
甲 | 乙 | 丙 | |
c(H2)/(mol·L-1) | 0.010 | 0.020 | 0.020 |
c(CO2)/(mol·L-1) | 0.010 | 0.010 | 0.020 |
下列判断不正确的是( )
A. 反应开始时,丙容器中化学反应速率最大,甲容器中化学反应速率最小
B. 平衡时,乙容器中CO2的转化率大于60%
C. 平衡时,甲容器中和丙容器中H2的转化率均是60%
D. 平衡时,丙容器中c(CO2)是甲容器中的2倍,是 0.012 mol·L-1
【题目】利用废钡渣(主要成分为BaS2O3,含少量SiO2)为原料生产高纯氟化钡的流程如下:
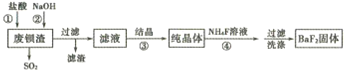
已知:Kap(BaS2O3)=6.96×10-11,Kap(BaF2)=1.0×10-6
(1)步骤①除产生SO2外,还有淡黄色固体生成,该反应的离子方程式为______________。
(2)步骤②的目的是中和过量的盐酸,加入NaOH溶液不宜过量,其原因是__________(用离子方程式表示)。
(3)滤液的主要成分是BaCl2,还含有少量NaCl,溶解度数据如下表:
温度 | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ |
NaCl | 36.0g | 36.6g | 37.3g | 39.0g | 39.8g |
BaCl2 | 35.8g | 40.8g | 46.2g | 52.5g | 59.4g |
步骤③宜采用_____ (填“蒸发结晶”或“降温结晶”)。
(4)工业上可用氨水吸收SO2,并通入空气使其转化为铵态氮肥。该转化中氧化剂与还原剂的物质的量之比为__________。
(5)步骤④生成BaF2的反应类型为____________。
①若该反应温度过高,容易造成c(F-)降低的原因是__________。
②研究表明,适当增加NH4F的比例有利于提高BaF2的产率和纯度,将浓度为0. 1mol·L-1的BaCl2溶液和0.22 mol·L-1NH4F溶液等体积混合,所得溶液中c(Ba2+)=__________ mol·L-1。