题目内容
【题目】铜是有色金属,被广泛地应用于电气、轻工、机械制造、建筑工业、国防工业等领域,铜的冶炼和加工对于现代社会有着重要的意义。
(1)工业上可用黄铜矿冶炼粗铜,简要流程如下:
![]()
在转炉中,经过两步反应生成粗铜,其的热化学方程式分别为:
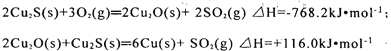
则总反应的热化学方程式为:_______________________________________;
(2)粗铜可用电解法精炼,电解过程中,粗铜应做____极;精铜一侧电极反应式为__________;
(3)电解精炼时粗铜中Fe、Zn等杂质元素会进入电解质溶液,一段时间后需要对电解液除杂净化,其中除去铁元素的一种操作如下:
![]()
下表为部分阳离子以氢氧化物形式沉淀时溶液的pH:

①试剂a是_______________,其作用是_________________________________________;
②溶液A加入CuO调节pH的目的是________________________________________(用必要的离子方程式和适当的文字说明)。
③操作①名称是________________。
(4)电解槽阳极泥中含有Ag、Au等贵金属,分离提纯Au的工艺流程如下:
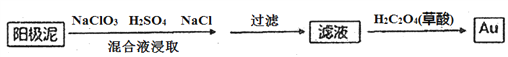
①滤液中Au元素的存在形式为[AuC14]-,写出浸取步骤反应的离子方程式________________。
②加入草酸后,滤液中发生氧化还原反应,生成Au单质,该反应中氧化剂和还原剂的物质的量之比为____________。
【答案】 Cu2S(s) + O2(g) = 2Cu(s) + SO2(g) ΔH=-217.4kJmol-1 阳极 Cu2+ + 2e- = Cu H2O2(或O2、O3等) 将Fe2+氧化为Fe3+,有利于后续反应除杂 Fe3+ + 3H2O![]() Fe(OH)3 + 3H+,CuO + 2H+ = H2O + Cu2+ ,CuO反应氢离子使Fe3+的水解平衡向右移动,生成Fe(OH)3沉淀 过滤 2Au + ClO3- + 7Cl- + 6H+ =2[AuCl4]- + 3H2O 2:3
Fe(OH)3 + 3H+,CuO + 2H+ = H2O + Cu2+ ,CuO反应氢离子使Fe3+的水解平衡向右移动,生成Fe(OH)3沉淀 过滤 2Au + ClO3- + 7Cl- + 6H+ =2[AuCl4]- + 3H2O 2:3
【解析】(1)据盖斯定律,将所给两式相加得:3Cu2S(s)+3O2(g)=6Cu(s)+3SO2(g)△H=(-768.2kJmol-1+116.0kJmol-1)=-652.2kJ/mol,再除以3得:Cu2S(s)+O2(g)=2Cu(s)+SO2(g)△H=-217.4kJ/mol;答案为:Cu2S(s) + O2(g) = 2Cu(s) + SO2(g) ΔH=-217.4kJmol-1
(2)粗铜主要发生反应为:Cu-2e-═Cu2+,发生氧化反应,阳极发生氧化反应,故粗铜做阳极;精铜做阴极发生还原反应,电极反应式为:Cu2+ + 2e- = Cu ;答案为:阳极 Cu2+ + 2e- = Cu
(3)①根据表中数据发现当三价铁离子形成沉淀时,铜离子不沉淀,可以将亚铁离子氧化为三价铁,再调节PH来除去亚铁离子,所以可以选择氧化剂双氧水或O2 、O3等,; ②加入CuO发生反应:CuO + 2H+ = H2O + Cu2+消耗Fe3+ + 3H2O≒Fe(OH)3 + 3H+产生的H+,使Fe3+的水解平衡向右移动,生成Fe(OH)3沉淀③可用过滤的方法除去沉淀,所以操作①是过滤。答案为:①H2O2(或O2 、O3等)、将Fe2+氧化为Fe3+,有利于后续反应除杂② Fe3+ + 3H2O≒Fe(OH)3 + 3H+,CuO + 2H+ = H2O + Cu2+ ,CuO反应氢离子使Fe3+的水解平衡向右移动,生成Fe(OH)3沉淀 ③过滤
(4)①单质Au在酸性环境下与NaClO3、NaCl反应生成![]() ,反应的离子方程式: 2Au + ClO3- + 7Cl- + 6H+ =2[AuCl4]- + 3H2O ② 加入草酸后[AuCl4]- 得到Au单质作氧化剂,草酸中的碳被氧化为CO2作还原剂,根据得失电子数相等可得氧化剂与还原剂的物质的量之比为:2:3.答案为:① 2Au + ClO3- + 7Cl- + 6H+ =2[AuCl4]- + 3H2O ②2:3
,反应的离子方程式: 2Au + ClO3- + 7Cl- + 6H+ =2[AuCl4]- + 3H2O ② 加入草酸后[AuCl4]- 得到Au单质作氧化剂,草酸中的碳被氧化为CO2作还原剂,根据得失电子数相等可得氧化剂与还原剂的物质的量之比为:2:3.答案为:① 2Au + ClO3- + 7Cl- + 6H+ =2[AuCl4]- + 3H2O ②2:3

 阅读快车系列答案
阅读快车系列答案