题目内容
【题目】实验室用氯酸钾和二氧化锰制取氧气的反应方程式为2KClO3![]() 2KCl+3O2↑。
2KCl+3O2↑。
回答下列问题:
(1)该反应中被氧化的元素的名称为____,生成1 mol O2时转移电子的数目是________。
(2)从反应后的固体混合物中分离出难溶于水的MnO2的具体实验操作名称:________。
(3)分离出的MnO2可用于实验室制取Cl2,化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,其离子方程式为________________________________。
MnCl2+Cl2↑+2H2O,其离子方程式为________________________________。
(4)若两个反应中转移的电子的物质的量相同,则生成的O2和Cl2在相同状况下的体积比为________。
(5)用双线桥法标明MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O电子转移的方向和数目_______。
MnCl2+Cl2↑+2H2O电子转移的方向和数目_______。
【答案】氧 4NA 过滤 MnO2+4H+2Cl-![]() Mn2++Cl2↑+2H2O 1:2
Mn2++Cl2↑+2H2O 1:2 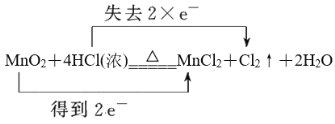
【解析】
反应2KClO3![]() 2KCl+3O2↑中Cl元素化合价由+5价变成-1价,O元素化合价由-2价变成0价,反应MnO2+4HCl(浓)
2KCl+3O2↑中Cl元素化合价由+5价变成-1价,O元素化合价由-2价变成0价,反应MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O中Mn元素化合价从+4价降低到+2价,氯元素化合价从-1价升高到0价,结合物质的性质、氧化还原反应的有关概念、电子得失守恒以及反应的方程式分析解答。
MnCl2+Cl2↑+2H2O中Mn元素化合价从+4价降低到+2价,氯元素化合价从-1价升高到0价,结合物质的性质、氧化还原反应的有关概念、电子得失守恒以及反应的方程式分析解答。
(1)O元素化合价由-2价变成0价,化合价升高失去电子被氧化,因此该反应中被氧化的元素的名称为氧;生成1mol O2时转移4mol电子,数目为4NA;
(2)从反应后的固体混合物中分离出难溶于水的MnO2应该采用过滤的方法;
(3)反应MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O的离子方程式为MnO2+4H+2Cl-
MnCl2+Cl2↑+2H2O的离子方程式为MnO2+4H+2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(4)反应2KClO3![]() 2KCl+3O2↑中生成3mol氧气转移12mol电子,反应MnO2+4HCl(浓)
2KCl+3O2↑中生成3mol氧气转移12mol电子,反应MnO2+4HCl(浓)![]() Cl2↑+MnCl2 +2H2O中生成1mol氯气转移2mol电子,则转移12mol电子时生成6mol氯气,所以转移电子的物质的量相同时生成的O2和Cl2在相同状况下的体积比为3:6=1:2;
Cl2↑+MnCl2 +2H2O中生成1mol氯气转移2mol电子,则转移12mol电子时生成6mol氯气,所以转移电子的物质的量相同时生成的O2和Cl2在相同状况下的体积比为3:6=1:2;
(5)反应MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O中Mn元素化合价从+4价降低到+2价得到2个电子,氯元素化合价从-1价升高到0价,失去1个电子,根据电子得失守恒可知转移电子数为2个,则电子转移的方向和数目可表示为
MnCl2+Cl2↑+2H2O中Mn元素化合价从+4价降低到+2价得到2个电子,氯元素化合价从-1价升高到0价,失去1个电子,根据电子得失守恒可知转移电子数为2个,则电子转移的方向和数目可表示为 。
。