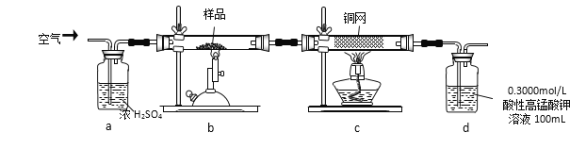
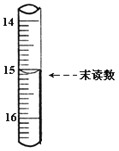
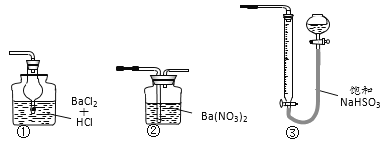
ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩΘ®1Θ©‘Ύ±ξΉΦΉ¥Ωωœ¬Θ§1.7gΑ±ΤχΥυ’ΦΒΡΧεΜΐΈΣ_____LΘ§Υϋ”κ±ξΉΦΉ¥Ωωœ¬_____LΝρΜ·«βΚ§”–œύΆ§ ΐΡΩΒΡ«β‘≠Ή”Θ°
Θ®2Θ©Ρ≥ΤχΧ§―θΜ·ΈοΒΡΜ·―ß ΫΈΣRO2Θ§‘Ύ±ξΉΦΉ¥Ωωœ¬Θ§1.28gΗΟ―θΜ·ΈοΒΡΧεΜΐΈΣ448mLΘ§‘ρΗΟ―θΜ·ΈοΒΡΡΠΕϊ÷ ΝΩΈΣ_____Θ°
Θ®3Θ©“―÷ΣCOΓΔCO2ΒΡΜλΚœΤχΧε÷ ΝΩΙ≤16.0gΘ§±ξΉΦΉ¥Ωωœ¬ΧεΜΐΈΣ8.96LΘ§‘ρΩ…ΆΤ÷ΣΗΟΜλΚœΤχΧε÷–Κ§CO_____gΘ§ΗΟΜλΚœΤχΧε“ΜΕ®ΧθΦΰœ¬Άξ»ΪΉΣΜ·ΈΣΕΰ―θΜ·ΧΦΚσΆ®»κ2.5mol/L«β―θΜ·ΡΤ»ή“ΚΘ§ΉνΕύœϊΚΡΗΟ«β―θΜ·ΡΤ»ή“ΚΧεΜΐ__________ml.
ΓΨ¥πΑΗΓΩ2.24 3.36 64gmol©¹1 2.80 320
ΓΨΫβΈωΓΩ
Θ®1Θ©άϊ”Οn=![]() Θ§V=nVmΦΑΖ÷Ή”ΒΡΙΙ≥…ά¥ΦΤΥψΘΜ
Θ§V=nVmΦΑΖ÷Ή”ΒΡΙΙ≥…ά¥ΦΤΥψΘΜ
Θ®2Θ©άϊ”Οn=![]() Θ§V=nVmΦΑΤχΧεΒΡΡΠΕϊ÷ ΝΩ”κœύΕ‘Ζ÷Ή”÷ ΝΩ‘Ύ ΐ÷Β…œœύΒ»ά¥Ζ÷ΈωΘΜ
Θ§V=nVmΦΑΤχΧεΒΡΡΠΕϊ÷ ΝΩ”κœύΕ‘Ζ÷Ή”÷ ΝΩ‘Ύ ΐ÷Β…œœύΒ»ά¥Ζ÷ΈωΘΜ
Θ®3Θ©ΗυΨίV=nVm≤Δάϊ”ΟΜλΚœΤχΧεΒΡ÷ ΝΩΚΆΈο÷ ΒΡΝΩά¥Ν– ΫΦΤΥψΘΜ
(1)1.7gΑ±ΤχΒΡΈο÷ ΒΡΝΩΈΣ![]() =0.1molΘ§ΤδΧεΜΐΈΣ0.1molΓΝ22.4L/mol=2.24LΘ§
=0.1molΘ§ΤδΧεΜΐΈΣ0.1molΓΝ22.4L/mol=2.24LΘ§
…ηΥϋ”κ±ξΉΦΉ¥Ωωœ¬VLΝρΜ·«βΚ§”–œύΆ§ ΐΡΩΒΡ«β‘≠Ή”Θ§‘ρ
0.1molΓΝ3=![]() ΓΝ2Θ§ΫβΒΟV=3.36Θ§
ΓΝ2Θ§ΫβΒΟV=3.36Θ§
Ι ¥πΑΗΈΣΘΚ2.24ΘΜ3.36ΘΜ
(2)ΤχΧεΒΡΈο÷ ΒΡΝΩΈΣ![]() =0.02molΘ§ΗΟ―θΜ·ΈοΒΡΡΠΕϊ÷ ΝΩΈΣ
=0.02molΘ§ΗΟ―θΜ·ΈοΒΡΡΠΕϊ÷ ΝΩΈΣ![]() =64 gmol©¹1Θ§
=64 gmol©¹1Θ§
Ι ¥πΑΗΈΣΘΚ64 gmol©¹1ΘΜ
(3)±ξΉΦΉ¥Ωωœ¬ΧεΜΐΈΣ8.96LΘ§‘ρΜλΚœΤχΧεΒΡΈο÷ ΒΡΝΩΈΣ8.96LΓ¬22.4L/mol=0.4molΘ§
…ηCOΓΔCO2ΒΡΈο÷ ΒΡΝΩΖ÷±πΈΣxΓΔyΘ§‘ρ
x+y=0.4
28x+44y=16.0Θ§ΫβΒΟx=0.1molΘ§y=0.3molΘ§
COΒΡ÷ ΝΩΈΣ0.1molΓΝ28g/mol=2.80gΘ§ΗυΨίΧΦ‘≠Ή” ΊΚψΩ…÷Σ…ζ≥…ΒΡΕΰ―θΜ·ΧΦ «0.4molΘ§Εΰ―θΜ·ΧΦΆ®»κ«β―θΜ·ΡΤ»ή“Κ÷–œϊΚΡΕΰ―θΜ·ΧΦΉνΕύ ±…ζ≥…ΧΦΥαΡΤΚΆΥ°Θ§ΗυΨί ΊΚψΙΊœΒΩ…÷Σ«β―θΜ·ΡΤΒΡΈο÷ ΒΡΝΩ «0.8molΘ§V=![]() =0.32L=320mLΘ§
=0.32L=320mLȧ
Ι ¥πΑΗΈΣΘΚ2.80ΘΜ320ΘΜ

 ΦβΉ”…ζ–¬ΩΈΧΟΩΈ ±Ής“ΒœΒΝ–¥πΑΗ
ΦβΉ”…ζ–¬ΩΈΧΟΩΈ ±Ής“ΒœΒΝ–¥πΑΗ ”Δ≤≈ΦΤΜ°Ά§≤ΫΩΈ ±ΗΏ–ß―ΒΝΖœΒΝ–¥πΑΗ
”Δ≤≈ΦΤΜ°Ά§≤ΫΩΈ ±ΗΏ–ß―ΒΝΖœΒΝ–¥πΑΗ