题目内容
【题目】某同学用Na2CO3和NaHCO3溶液进行如图所示实验。下列说法中,正确的是( )
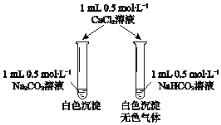
A.实验前两电解质在溶液中都有电离平衡存在
B.实验前两溶液中离子种类完全相同
C.加入CaCl2溶液后生成的沉淀一样多
D.实验前两溶液的pH右>左
【答案】B
【解析】
A. Na2CO3在溶液中完全电离,电离产生的CO32-发生水解,NaHCO3在溶液中完全电离,电离生成的HCO3-在溶液中既能电离又能水解,所以实验前Na2CO3在溶液中不存在电离平衡,但NaHCO3在溶液中存在电离平衡,A错误;
B. 实验前两溶液中都存在Na+、CO32-、HCO3-、OH-、H+,离子种类完全相同,B正确。
C. 加入CaCl2溶液后生成的沉淀不一样多,因为Na2CO3+CaCl2=CaCO3↓+2NaCl,2NaHCO3+CaCl2=CaCO3↓+NaCl+H2O+CO2↑,C错误;
D. 实验前相同浓度的Na2CO3和NaHCO3溶液,前者水解程度大,所以两溶液的pH左>右,D错误。
故选B。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
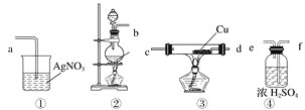
【题目】利用如图所示的仪器和药品(必要时可加热),能够达到实验目的是( )
试剂a | 试剂b | 试剂c | 实验目的 |
| |
① | 盐溶液X | NaOH | 酚酞 | 证明X中含有NH4+ | |
② | 浓盐酸 | CaCO3 | Na2SiO3溶液 | 证明酸性: HCl>H2CO3>H2SiO3 | |
③ | 浓盐酸 | MnO2 | 淀粉KI溶液 | 证明氧化性:MnO2>Cl2>I2 | |
④ | 浓硫酸 | C | 澄清石灰水 | 证明产物中含有CO2 |
A.①②③B.①③C.②③D.①②③④