题目内容
【题目】有一包白色粉末,可能由NaCl、Na2CO3、Na2SO4中的一种或几种组成,为鉴别其成分进行如下实验(每步加入试剂都是足量的):
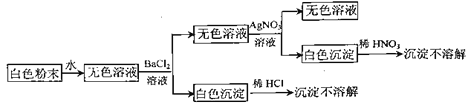
下列说法错误的是( )
A.粉末中一定含有NaClB.粉末中一定含有Na2SO4
C.粉末中一定不含Na2CO3D.粉末可能是纯净物
【答案】A
【解析】
白色粉末加入水溶解得到无色溶液,加入氯化钡生成白色沉淀,且沉淀不溶于盐酸,可知应含有Na2SO4,无色溶液加入硝酸银生成沉淀,且沉淀不溶于硝酸,则沉淀为AgCl,但因加入氯化钡,引入氯离子,则不能证明是否含有NaCl,实验过程生成的沉淀不溶于硝酸或盐酸,说明没有生成碳酸钡或碳酸银,则不含Na2CO3,以此解答该题。
由以上分析可知不含Na2CO3,一定含有Na2SO4,可能含有NaCl,如不含NaCl,则粉末为纯净物,只有A错误。
故选:A。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目