题目内容
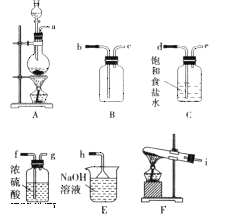
【题目】某研究小组模拟工业上以黄铁矿为原料制备硫酸的第一步反应如下:4FeS2+11O2![]() 2Fe2O3+8SO2进行以下实验,并测定该样品中FeS2样品的纯度(假设其它杂质不参与反应)。
2Fe2O3+8SO2进行以下实验,并测定该样品中FeS2样品的纯度(假设其它杂质不参与反应)。
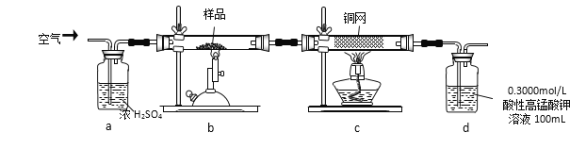
实验步骤:称取研细的样品4.000g放入上图b装置中,然后在空气中进行煅烧。为测定未反应高锰酸钾的量(假设其溶液体积保持不变),实验完成后取出d中溶液10mL置于锥形瓶里,用0.1000mol/L草酸(H2C2O4)标准溶液进行滴定。(已知:5SO2 + 2KMnO4 + 2H2O = K2SO4 + 2MnSO4 + 2H2SO4 )请回答下列问题:
(1)称量样品质量能否用托盘天平_______(填“能”或“不能”),取出d中溶液10mL需要用______准确量取(填序号)
A.容量瓶 B.量筒 C.碱式滴定管 D.酸式滴定管
(2)上述反应结束后,仍需通一段时间的空气,其目的是__________
(3)已知草酸与高锰酸钾酸性溶液作用有CO2和Mn2+等物质生成,则滴定时发生反应的离子方程式为_______________﹔判断滴定到达终点的方法是___________。
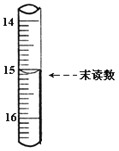
(4)已知滴定管初读数为0.10mL,末读数如图所示,消耗草酸溶液的体积为___________mL。
下列操作会导致该样品中FeS2的纯度测定结果偏高的是_________(填序号)
A.盛标准溶液的滴定管用蒸馏水洗涤后未用标准液润洗就装液滴定
B.锥形瓶用蒸馏水洗涤后未用待测液润洗
C.读取标准液读数时,滴定前平视,滴定到终点后俯视
D.滴定前滴定管尖嘴处有气泡未排除,滴定后气泡消失
(5)该样品中FeS2的纯度为__________________
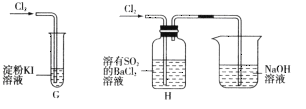
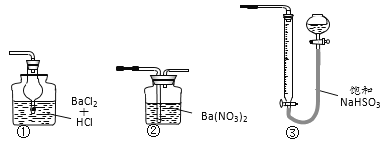
(6)若用下图装置替代上述实验装置d,同样可以达到实验目的的是_______(填编号)。
【答案】不能 D 促进装置中的二氧化硫气体全部吸收 2MnO4—+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O 滴入最后一滴草酸溶液, 溶液由紫红色变为无色,且半分钟内不恢复 15.00 C 90% ②
【解析】
将空气通入浓硫酸中将空气干燥,在b中氧气和二硫化亚铁发生反应为4FeS2+11O2 ![]() 2Fe2O3+8SO2,然后将气体再通入c中,发生的反应为2Cu+O2
2Fe2O3+8SO2,然后将气体再通入c中,发生的反应为2Cu+O2 ![]() 2CuO,然后将气体通入d中,二氧化硫能被高锰酸钾溶液氧化生成硫酸;
2CuO,然后将气体通入d中,二氧化硫能被高锰酸钾溶液氧化生成硫酸;
(1)称量样品质量感量为0.001g,托盘天平感量为0.1g;d中溶液呈酸性且具有强氧化性,应该用酸式滴定管量取;
(2)为使b中生成的二氧化硫全部被d中酸性高锰酸钾溶液吸收,所以实验中应将b装置中二氧化硫全部驱赶到d装置中;
(3)草酸与高锰酸钾酸性溶液作用有CO2和Mn2+等物质生成,则滴定时发生反应的离子方程式为 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O﹔判断滴定到达终点的方法是滴入最后一滴草酸溶液,溶液由紫红色变为无色,且半分钟内不恢复;
(4)依据滴定管的结构,利用开始和结束的体积差值计算得到消耗草酸溶液的体积;滴定过程中如果使用的草酸体积偏大,未与SO2反应的高锰酸钾偏大,则测定的二硫化亚铁的质量分数就偏小;
(5)依据灼烧反应和滴定反应的定量关系计算二硫化亚铁的质量分数;
(6)装置d是用于吸收并测定产物中二氧化硫的含量,根据二氧化硫的化学性质进行判断。
将空气通入浓硫酸中将空气干燥,在b中氧气和二硫化亚铁发生反应为4FeS2+11O2![]() 2Fe2O3+8SO2,然后将气体再通入c中,发生的反应为2Cu+O2
2Fe2O3+8SO2,然后将气体再通入c中,发生的反应为2Cu+O2![]() 2CuO,然后将气体通入d中,二氧化硫能被高锰酸钾溶液氧化生成硫酸;
2CuO,然后将气体通入d中,二氧化硫能被高锰酸钾溶液氧化生成硫酸;
(1)称量样品质量感量为0.001g,托盘天平感量为0.1g,所以不能用托盘天平称量样品质量;d中溶液呈酸性且具有强氧化性,应该用酸式滴定管量取,故答案为D;
(2) 实验的目的是测量FeS2的纯度,为使b中生成的二氧化硫全部被d中酸性高锰酸钾溶液吸收,所以反应结束后,仍需通一段时间的空气,其目的是:将b装置中二氧化硫全部驱赶到d装置中,使SO2被完全吸收;
(3)草酸与高锰酸钾酸性溶液作用有CO2和Mn2+等物质生成,则滴定时发生反应的离子方程式为 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O﹔判断滴定到达终点的方法是滴入最后一滴草酸溶液,溶液由紫红色变为无色,且半分钟内不恢复;
(4)依据滴定管的结构,末读数为15.10mL,利用开始和结束的体积差值计算得到消耗草酸溶液的体积为:15.10mL-0.10mL=15.00mL;
A.盛标准溶液的滴定管用蒸馏水洗涤后未用标准液润洗就装液滴定,导致草酸浓度降低,则使用的草酸体积偏大,导致未与二氧化硫反应的高锰酸钾物质的量偏大,二硫化亚铁测定值偏低;
B.锥形瓶用蒸馏水洗涤后未用待测液润洗,不影响测定;
C.读取标准液读数时,滴定前平视,滴定到终点后俯视,导致草酸体积偏小,未与二氧化硫反应的高锰酸钾物质的量偏小,二硫化亚铁测定值偏高;
D.滴定前滴定管尖嘴处有气泡未排除,滴定后气泡消失,导致草酸体积偏大,未与二氧化硫反应的高锰酸钾物质的量偏大,二硫化亚铁的测定值偏低;
故答案为C;
(5)根据离子方程式:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,100mL溶液中剩余高锰酸钾物质的量为:![]() ×0.01500L×0.1000mol/L×
×0.01500L×0.1000mol/L×![]() =0.006mol,与二氧化硫反应的高锰酸钾物质的量为:0.3000mol/L×0.1000L-0.006mol=0.024mol,结合反应5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4可得:
=0.006mol,与二氧化硫反应的高锰酸钾物质的量为:0.3000mol/L×0.1000L-0.006mol=0.024mol,结合反应5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4可得:
5FeS2~10SO2~4KMnO4
5 4
n(FeS2) 0.024mol
![]() ,解得n(FeS2)=0.03mol,则样品中FeS2的纯度为:
,解得n(FeS2)=0.03mol,则样品中FeS2的纯度为:![]() ×100%=90%;
×100%=90%;
(6)①中溶液不能吸收SO2,无法测定SO2;②中溶液吸收二氧化硫生成硫酸钡沉淀,可测定SO2,可以替代装置d;③SO2中混有的N2等不溶于水,干扰了二氧化硫的测定;故答案为②。

 寒假学与练系列答案
寒假学与练系列答案