题目内容
A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素。它们之间的关系如下:
Ⅰ.原子半径:A < C < B < E< D
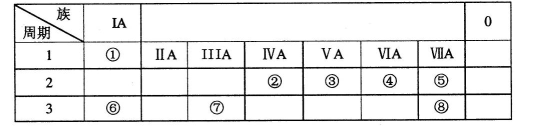
Ⅱ.原子的最外层电子数:A = D C= E A + B = C
Ⅲ.原子的核外电子层数:B =" C" = 2A
Ⅳ.B元素的主要化合价:最高正价 + 最低负价 = 2
请回答:
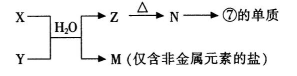
(1)甲为由A、B两种元素组成的常见气体,写出其电子式 ;
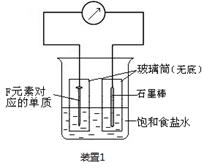
(2)写出某黑色含F的磁性氧化物与E最高价氧化物对应水化物的稀溶液反应的离子方程式: 。装置1经过一段时间向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为 。单质F发生 (填电化学腐蚀类型)
(3)向A、B、C三种元素组成的某盐稀溶液中滴加AgNO3溶液生成白色沉淀,该反应的化学方程式为 ,已知该盐溶液常温下呈酸性,则0.1mol/L该盐溶液中离子浓度的大小顺序为 。
(4)上述元素中的五种元素可形成一种常见复盐,经检测该复盐中三种离子的个数比为2:1:2。则该复
盐的化学式为 。为检验该复盐中的某种有色离子存在,请写出实验的操作步骤和现象
。
Ⅰ.原子半径:A < C < B < E< D
Ⅱ.原子的最外层电子数:A = D C= E A + B = C
Ⅲ.原子的核外电子层数:B =" C" = 2A
Ⅳ.B元素的主要化合价:最高正价 + 最低负价 = 2
请回答:
(1)甲为由A、B两种元素组成的常见气体,写出其电子式 ;
(2)写出某黑色含F的磁性氧化物与E最高价氧化物对应水化物的稀溶液反应的离子方程式: 。装置1经过一段时间向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为 。单质F发生 (填电化学腐蚀类型)

(3)向A、B、C三种元素组成的某盐稀溶液中滴加AgNO3溶液生成白色沉淀,该反应的化学方程式为 ,已知该盐溶液常温下呈酸性,则0.1mol/L该盐溶液中离子浓度的大小顺序为 。
(4)上述元素中的五种元素可形成一种常见复盐,经检测该复盐中三种离子的个数比为2:1:2。则该复
盐的化学式为 。为检验该复盐中的某种有色离子存在,请写出实验的操作步骤和现象
。
(共14分)(1)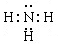 (1分)
(1分)
(2) Fe3O4+8H+=2Fe3++ Fe2++4H2O (2分);O2+2H2O+4e-=4OH- (2分) 吸氧腐蚀(1分)
(3) NH4NO2 + AgNO3=AgNO2↓+NH4NO3;c(NO2->c(NH4+)>c(H+)>c(OH-)(各2分)
(4)(NH4)2Fe(SO4)2、取少量该复盐于试管中并加水溶解,滴加KSCN溶液,无明显现象,再滴加新制氯水,溶液立即变红色,证明有Fe2+(或加氢氧化钠溶液,出现白色沉淀迅速变成灰绿色,最终变成红褐色。其他方案合理均可。)(各2分)
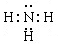 (1分)
(1分)(2) Fe3O4+8H+=2Fe3++ Fe2++4H2O (2分);O2+2H2O+4e-=4OH- (2分) 吸氧腐蚀(1分)
(3) NH4NO2 + AgNO3=AgNO2↓+NH4NO3;c(NO2->c(NH4+)>c(H+)>c(OH-)(各2分)
(4)(NH4)2Fe(SO4)2、取少量该复盐于试管中并加水溶解,滴加KSCN溶液,无明显现象,再滴加新制氯水,溶液立即变红色,证明有Fe2+(或加氢氧化钠溶液,出现白色沉淀迅速变成灰绿色,最终变成红褐色。其他方案合理均可。)(各2分)
试题分析:A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素。根据原子的核外电子层数:B=C=2A可知,A为H元素,B、C为第二周期元素。原子的最外层电子数A=D,则D为Na元素。根据B元素的主要化合价:最高正价+最低负价=2可知。B为N元素。根据原子的最外层电子数:A+B=C可知,C为O元素。原子的最外层电子数:C=E可知,E为S元素。根据题中“某黑色含F的磁性氧化物”可知,F为Fe元素。
(1)A为H元素,B为N元素,甲为由A、B两种元素组成的常见气体,应为NH3。氨气是含有极性键的共价化合物,其电子式为
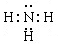 。
。(2)黑色含F的磁性氧化物是四氧化三铁,其中Fe元素的化合价有+2价和+3价两种。E最高价氧化物对应水化物是硝酸,具有强氧化性,其稀溶液与四氧化三铁反应的离子方程式是Fe3O4+8H+=2Fe3++ Fe2++4H2O;根据装置1的构成可知,该装置是原电池,其中铁是负极,碳棒是正极。由于溶液是食盐水,所以发生的是钢铁的吸氧腐蚀,其中正极是氧气得到电子,其电极反应式是O2+2H2O+4e-=4OH-。
(3)A、B、C三种元素组成的盐为NH4NO2或NH4NO3,滴加AgNO3溶液生成白色沉淀,应为AgNO2沉淀,因为AgNO3溶于水,所以反应的化学方程式是NH4NO2 + AgNO3=AgNO2↓+NH4NO3;NH4NO2为强酸弱碱盐,水解呈酸性,所以溶液中离子浓度大小顺序为c(NO2->c(NH4+)>c(H+)>c(OH-)。
(4)复盐中三种离子的个数比为2:1:2,常见为(NH4)2Fe(SO4)2。其中有色离子是亚铁离子,亚铁离子具有还原性,其检验方法是取少量该复盐于试管中并加水溶解,滴加KSCN溶液,无明显现象,再滴加新制氯水,溶液立即变红色,证明有Fe2+(或加氢氧化钠溶液,出现白色沉淀迅速变成灰绿色,最终变成红褐色。或者滴加铁氰化钾溶液【K3[Fe(CN)6]】,立即有铁氰化亚铁的蓝色沉淀出现,反应式为:2Fe(CN)63-+Fe2+=Fe3[Fe(CN)6]2↓,证明有Fe2+。

练习册系列答案
相关题目
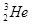 核聚变所释放出的能量相当于目前人类一年消耗的能量,在地球上氦元素主要以
核聚变所释放出的能量相当于目前人类一年消耗的能量,在地球上氦元素主要以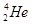 的形式存在。有关该元素说法正确的是
的形式存在。有关该元素说法正确的是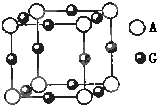 。若阿伏伽德罗常数为NA,该化合物晶体的密度为 a g/cm3,其晶胞的边长为 cm。
。若阿伏伽德罗常数为NA,该化合物晶体的密度为 a g/cm3,其晶胞的边长为 cm。