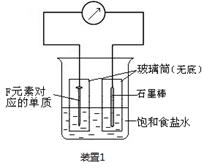
题目内容
由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有下图的转化关系,已知C为密度最小的气体,甲为非电解质。
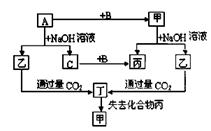
根据以上转化关系回答下列问题:
(1)写出下列物质的化学式:A B 丁 。
(2)元素A在周期表中的位置是 ,写出甲的一种用 途 。
(3)写出下列变化的方程式:
A与NaOH溶液反应的化学方程式 。
乙与过量CO2反应的离子方程式 。

根据以上转化关系回答下列问题:
(1)写出下列物质的化学式:A B 丁 。
(2)元素A在周期表中的位置是 ,写出甲的一种用 途 。
(3)写出下列变化的方程式:
A与NaOH溶液反应的化学方程式 。
乙与过量CO2反应的离子方程式 。
(1)Si(2分) O2(2分) H2SiO3或H4SiO4(2分)
(2)第三周期第ⅣA族(2分) 是玻璃、光导纤维等(2分)
(3) ①Si+2NaOH+H2O=Na2SiO3+2H2↑(2分)
② SiO32—+2CO2+2H2O=H2SiO3↓+2HCO3—(2分)
试题分析:根据题意可知A:SiB:O2、C:H2、甲:SiO2、乙:Na2SiO3、丙:H2O、丁:H2SiO3。
(1)突破口:C为密度最小的气体,知C是H2;甲为非电解质,不能是Al2O3,只能是SiO2;则A为Si、B为O2、 乙是Na2SiO3,通CO2生成丁,丁为H2SiO3。丁失去丙生成甲,丙为H2O。
(2)A为Si,在周期表的第三周期第ⅣA族;用途是做玻璃、光导

练习册系列答案
相关题目