题目内容
2SO2(g)+O2(g) 2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。
2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。
请回答下列问题:
(1)图中A、C分别表示__________、__________,E的大小对该反应的反应热有无影响?____________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?___________。
(2)图中ΔH=__________kJ/mol;
(3)如果反应速率v(SO2)为0.05 mol/(L·min),则v(O2)=____mol/(L·min)
(4)已知单质硫的燃烧热为296 kJ/mol,计算由S(s)生成3 mol SO3(g)的ΔH=_ 。
(1)反应物能量 生成物能量 没有影响 降低 (2)-198 (3)0.025 (4)-1185 kJ/mol
解析试题分析:(1)由图可看出A表示反应物的总能量。C表示生成物的总能量。A—B的能量差即E表示该反应的活化能。A—C的能量差表示该反应的反应热。反应的活化能与反应热的大小无关。加入催化剂,能改变反应途径,降低反应的活化能。使更多的能量低的分子变为活化分子,提高了活化分子的百分数。因而加快了反应速率。由于反应物的能量高,生成物的能量低,由反应物变为生成物时,放出热量。即该反应是个放热反应。
(2)该反应是2mol的SO2发生的反应。因此反应热ΔH=2×(-99 )kJ/mol="-198" kJ/mol。
(3)对于同一个化学反应来说,用不同物质来表示反应速率,速率比等于它们的化学方程式中的计量数的比。也就是v(SO2):v(O2)=2:1.∵v(SO2)="0.05" mol/(L·min)所以v(O2)="0.025" mol/(L·min)(4)3mol的单质硫燃烧产生二氧化硫放出热量:3mol×296 kJ/mol=888KJ.3摩尔二氧化硫气体转化为SO3(g)时又放出热量:3mol×99 kJ/mol=297KJ.所以一共放热888KJ+297KJ1185KJ.即由S(s)生成3 mol SO3(g)的ΔH=-1185 kJ/mol。
考点:考查反应热与反应物、生成物的能量关系的知识。

氮可形成多种氧化物,如NO、NO2、N2O4等。已知NO2和N2O4的结构式分别是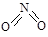 和
和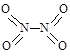 。实验测得N-N键键能为167kJ·mol-1, NO2中氮氧键的平均键能为466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
。实验测得N-N键键能为167kJ·mol-1, NO2中氮氧键的平均键能为466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
(1)写出N2O4转化为NO2的热化学方程式:
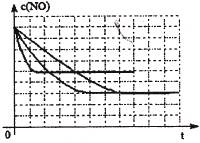
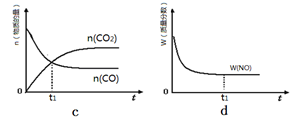
(2)对反应N2O4(g) 2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 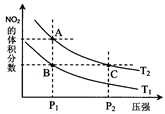
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(3)在100℃时,将0.40mol的NO2气体充入2 L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.050 | n2 | 0.080 | 0.080 |
①在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为
②n3 n4(填“>”、“<”或“=”),该反应的平衡常数K的值为 ,升高温度后,反应2NO2
 N2O4的平衡常数K将 (填“增大”、“减小”或“不变”)。
N2O4的平衡常数K将 (填“增大”、“减小”或“不变”)。③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是_____________mol·L-1。

 7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。 2SO3(g) ΔH="-196.6" kJ·mol-1
2SO3(g) ΔH="-196.6" kJ·mol-1 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0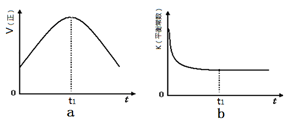
 N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol  2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。
2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。


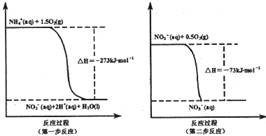
 2CO2+ N2 △H
2CO2+ N2 △H